ГИДРАТАЦИЯ. ГИДРАТЫ. ГИДРОЛИЗ
ГИДРАТАЦИЯ. ГИДРАТЫ. ГИДРОЛИЗ. Гидратация (греч. «хюдор» – вода) – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называются гидратами. Гидролиз (греч. «лисис» – разложение, растворение) – химическая реакция разложения вещества водой.
В течение многих лет химики считали растворение веществ в воде чисто физическим процессом. И сейчас в школьных учебниках к таковым относят, например, растворение в воде сахара. Действительно, при испарении воды из раствора сахара при пониженном давлении легко получить исходное вещество в неизменном виде.
В то же время накапливались данные о том, что процесс растворения нельзя считать чисто механическим смешением компонентов, как, например, гексана и гептана. Так, растворы хлорида натрия и многих других соединений обладают электропроводностью, а сам процесс растворения нередко сопровождается значительными тепловыми эффектами (см. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ). Более того, некоторые соединения при растворении изменяют даже цвет. Например, сульфат меди бесцветный, а его разбавленный раствор – голубой, хлорид кобальта(II) голубой, а его водные растворы розовые. Все эти факты показывают, что растворение в воде – физико-химический процесс, вызванный гидратацией, то есть взаимодействием вещества с водой.
В ходе гидратации в ряде случаев происходит обратимое присоединение воды к ионам, атомам или молекулам растворяемого вещества с образованием гидратов. Так, при растворении в воде кристаллических ионных соединений (солей, щелочей, а также некоторых кислот, например, лимонной и щавелевой), молекулярных соединений (хлороводорода, серной кислоты, спирта, глюкозы и др.) происходит гидратация катионов и анионов, из которых состоит растворяемое вещество, либо гидратация ионов, образующихся в процессе растворения. При этом молекулы воды сохраняются как целое.
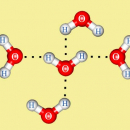
В процессе гидратации ионов участвует множество молекул воды, которые, благодаря электростатическим силам, окружают ионы со всех сторон гидратной «шубой», при этом лишь несколько молекул воды образуют первый, наиболее прочно связанный с центральным ионом слой. В целом же при гидратации ионов выделяется значительная энергия, так, при гидратации катионов Н+ выделяется 1076 кДж/моль – это в 2,5 раза больше энергии диссоциации молекул Н2 на атомы. Энергия гидратации тем больше, чем меньше размер иона и чем больше его заряд. Например, энергия гидратации большого по размерам иона Cs+ в 4 раза меньше, чем для иона Н+. Энергию гидратации ионов трудно определить экспериментально, но можно рассчитать на основании электростатических моделей. Энергии гидратации некоторых ионов приведены в таблице.
| Ион | Энергия гидратации, кДж/моль | Ион | Энергия гидратации, кДж/моль |
| H+ | 1076 | Sr2+ | 1477 |
| H3O+ | 460 | Ba2+ | 1339 |
| Li+ | 502 | Zn2+ | 2130 |
| Na+ | 410 | Al3+ | 4548 |
| K+ | 329 | F– | 473 |
| NH4+ | 330 | Cl– | 330 |
| Rb+ | 314 | Br– | 296 |
| Cs+ | 264 | I– | 264 |
| Mg2+ | 1887 | OH– | 339 |
| Ca2+ | 1569 | MnO4– | 247 |
Алгебраическая сумма энергии кристаллической решетки (или энергии разрыва связей) растворяемого вещества и энергии гидратации ионов определяет суммарный тепловой эффект растворения. В случае ионных соединений процесс может быть существенно экзотермическим (растворение в воде серной кислоты, гидроксидов натрия и калия может вызвать даже вскипание раствора), существенно эндотермическим (стакан с водой, в котором быстро растворяют нитрат аммония, примерзает к влажной подставке) или термонейтральным (растворение бромида натрия практически не сопровождается изменением температуры).
Гидратация многих безводных солей дозированным количеством воды (например, из газовой фазы) приводит к образованию твердых гидратов определенного состава, которые называются кристаллогидратами. Этот процесс всегда сопровождается выделением теплоты. Гидратация может быть ступенчатой, в зависимости от количества доступной воды и температуры. Одновременно может изменяться и цвет ионов. Например, при гидратации бесцветного сульфата меди(II) последовательно образуются различные окрашенные кристаллогидраты, из которых выделены в чистом виде моногидрат CuSO4·H2O, тригидрат CuSO4·3H2O и пентагидрат (медный купорос) CuSO4·5H2O. В разбавленных растворах присутствуют cине-зеленые гидраты – аква-ионы Cu(OH)62+. Потеря воды розовым аква-ионом Со(Н2О)42+ приводит к появлению синей окраски.
При кристаллизации многих солей из их водных растворов молекулы воды входят в состав кристаллической решетки с образованием кристаллогидратов различного состава, например, LiCl·H2O, CuCl2·2H2O, Ba(ClO4)2·3H2O, CdBr2·4H2O, Na2S2O3·5H2O, AlCl3·6H2O, FeSO4·7H2O, MgI2·8H2O, Fe(NO3)3·9H2O, Na2SO4·10H2O, Na2HPO4·12H2O, Al2(SO4)3·18H2O и др. При нагревании, а также при хранении на воздухе (особенно при низкой влажности) многие кристаллогидраты выветриваются, теряя частично или полностью молекулы воды.
Гидратация молекулярных соединений происходит обычно за счет водородных связей и, как правило, не сопровождается существенным тепловым эффектом. Примером может служить растворение сахара. Молекулы воды легко образуют водородные связи с гидроксильными группами, поэтому даже вещества с большими молекулами хорошо растворяются в воде, если содержат много гидроксильных групп (сахароза, поливиниловый спирт). Соединения с небольшими полярными молекулами также легко гидратируются полярными молекулами воды, поэтому такие соединения обычно хорошо растворяются в воде. Примером может служить ацетонитрил СН3CN, который смешивается с водой в любых отношениях.
Необычные гидраты с некоторыми соединениями образует вода, находящаяся в твердом состоянии. В этих гидратах атомы, молекулы ряда веществ включаются в пустоты кристаллической решетки льда. Эти пустоты могут заполняться небольшими молекулами, такими как О2, N2, H2S, СН4, атомами благородных газов. Такие соединения «без химической связи» называют газовыми гидратами. Другие их название – клатраты (соединения включения). Отсутствие химических связей приводит к самым необычным соотношениям молекул воды и включенного вещества. Например, при низких температурах устойчивы соединения, содержащие на 46 молекул Н2О восемь атомов аргона, криптона, ксенона или радона. А вот маленькие атомы гелия и неона таких клатратов не образуют, так как они «ускользают» из слишком больших для них пустот. Клатрат состава Сl2·8H2O получил еще Дэви в 1811 из насыщенного при 0° С водного раствора хлора.
Клатраты, образованные водой и метаном, а также другими газами, часто называют газовыми гидратами. Внешне они похожи на снег или рыхлый лет, но под давлением могут существовать и при плюсовых температурах. Поэтому газовые гидраты могут закупорить газопровод и привести к аварии. Гидраты метана широко распространены в природе, в особенности на шельфе океанов; запасы природного газа в виде газовых гидратов значительно превышают его запасы в свободном состоянии.
Гидратация как химическое взаимодействие с водой может сопровождаться разрушением молекул воды, в этом случае происходит необратимая химическая реакция, которую обычно называют гидролизом – разложением водой. Реакции гидролиза известны как в неорганической, так и в органической химии. Примерами гидролиза неорганических соединений могут служить следующие процессы:
SO3 + H2O ® H2SO4, СаО + Н2О ® Са(ОН)2, SOCl2 + H2O ® SO2 + 2HCl, СаС2 + 2Н2О ® Са(ОН)2 + С2Н2, PCl3 + 3H2O ® H3PO4 + HCl, BF3 + 3H2O ® H3BO3 + 3HF.
Гидролиз солей, образованных сильным основанием (щелочью) и слабой кислотой или слабым основанием и сильной кислотой сопровождается изменением кислотности среды: Na2S + H2O ® NaHS + NaOH, AlCl3 + H2O ® Al(OH)Cl2 + HCl. В случае таких солей как Al2S3 (их можно получить только сухим путем) гидролиз идет до конца с выделением гидроксида металла и слабой кислоты.
В органической химии реакции гидролиза сопровождаются либо разрушением органической молекулы (гидролиз сложных эфиров, белков): CH3COOC2H5 + H2O ® CH3COOH + C2H2OH, либо заменой в молекуле какой-либо группы на остаток молекулы воды, обычно гидроксил (гидролиз алкилгалогенидов): C2H5Br + H2O ® C2H5OH + HBr. В обоих случаях гидролизу способствует присутствие щелочи, которая связывает выделяющуюся кислоту. В случае белков и других биологически активных молекул реакцию гидролиза направляют в нужном направлении специальные ферменты – гидролазы. Например, фермент амилаза способствует гидролизу крахмала; фермент трипсин направленно гидролизует в белках пептидные связи, образованные аминокислотами аргинином и лизином.
Примерами реакции гидратации в органической химии может служить каталитическая гидратация алкенов с образованием спиртов:
С2Н4 + Н2О ® С2Н5ОН и каталитическая гидратация алкинов с образованием альдегидов или кетонов: С2Н2 + Н2О ® CH3CHO, СН3–СєСН + Н2О ® СН3–СО–СН3.
Реакции гидратации широко используются в промышленном органическом синтезе. Например, каталитической гидратацией из этилена получают этиловый спирт, из пропилена – пропиловый спирт, из ацетилена – уксусный альдегид, из метилацетилена – ацетон. Реакция гидратации с образованием гидратов является ключевой при формовании изделий из гипса, при «схватывании» цемента. Образование газовых гидратов используют для разделения многокомпонентных газовых смесей. Наличие запасов гидратов метана в недрах Земли перспективно для будущей добычи природного газа. Реакции гидролиза широко используются в лабораторной практике и в промышленности. Гидролизом целлюлозы получают называемый гидролизный этиловый спирт, гидролизом сахарозы – глюкозу и фруктозу, гидролизом жиров – глицерин и соли карбоновых кислот – мыла. Ферментативный гидролиз органических соединений широко применяется в пищевой, текстильной и фармацевтической промышленности.
Илья Леенсон
А.В.Карякин, Г.А.Кривенцова. Состояние воды в органических и неорганических соединениях. М., Химия, 1973
МакогонЮ.Ф. Газовые гидраты, предупреждение их образования и использование. М., Химия, 1985
Ответь на вопросы викторины «Неизвестные подробности»