ХИМИЧЕСКАЯ КИНЕТИКА
ХИМИЧЕСКАЯ КИНЕТИКА – (от греч. кинетикос – движущий) наука о механизмах химических реакций и закономерностях их протекания во времени.
В 19 в. результате развития основ химической термодинамики химики научились рассчитывать состав равновесной смеси для обратимых химических реакций. Кроме того, на основании несложных расчетов можно было, не проводя экспериментов, сделать вывод о принципиальной возможности или невозможности протекания конкретной реакции в данных условиях. Однако «принципиальная возможность» реакции еще не означает, что она пойдет. Например, реакция С + О2 → СО2 с точки зрения термодинамики весьма благоприятна, во всяком случае, при температурах ниже 1000° С (при более высоких температурах происходит уже распад молекул СО2), т.е. углерод и кислород должны (практически со 100%-ным выходом) превратиться в диоксид углерода. Однако опыт показывает, что кусок угля может годами лежать на воздухе, при свободном доступе кислорода, не претерпевая никаких изменений. То же можно сказать и о множестве других известных реакций. Например, смеси водорода с хлором или с кислородом могут сохраняться очень долго без всяких признаков химических реакций, хотя в обоих случаях реакции термодинамически благоприятны. Это означает, что после достижения равновесия в стехиометрической смеси H2 + Cl2 должен остаться только хлороводород, а в смеси 2Н2 + О2 – только вода. Другой пример: газообразный ацетилен вполне стабилен, хотя реакция C2H2 → 2C + H2 не только термодинамически разрешена, но и сопровождается значительным выделением энергии. Действительно, при высоких давлениях, ацетилен взрывается, однако в обычных условиях он вполне стабилен.
Термодинамически разрешенные реакции, подобные рассмотренным, могут пойти только в определенных условиях. Например, после поджигания уголь или сера самопроизвольно соединяются с кислородом; водород легко реагирует с хлором при повышении температуры или при действии ультрафиолетового света; смесь водорода с кислородом (гремучий газ) взрывается при поджигании или при внесении катализатора. Почему же для осуществления всех этих реакций необходимы специальные воздействия – нагревание, облучение, действие катализаторов? Химическая термодинамика не дает ответа на этот вопрос – понятие времени в ней отсутствует. В то же время для практических целей очень важно знать, пройдет ли данная реакция за секунду, за год или же за многие тысячелетия.
Опыт показывает, что скорость разных реакций может отличаться очень сильно. Практически мгновенно идут многие реакции в водных растворах. Так, при добавлении избытка кислоты к щелочному раствору фенолфталеина малинового цвета раствор мгновенно обесцвечивается, это означает, что реакция нейтрализации, а также реакция превращения окрашенной формы индикатора в бесцветную идут очень быстро. Значительно медленнее идет реакция окисления водного раствора иодида калия кислородом воздуха: желтая окраска продукта реакции – иода появляется лишь через продолжительное время. Медленно протекают процессы коррозии железных и особенно медных сплавов, многие другие процессы.
Предсказание скорости химической реакции, а также выяснение зависимости этой скорости от условий проведения реакции – одна из важных задач химической кинетики – науки, изучающей закономерности протекания реакций во времени. Не менее важна и вторая задача, стоящая перед химической кинетикой – изучение механизма химических реакций, то есть детального пути превращения исходных веществ в продукты реакции.
Скорость реакции.
Проще всего определить скорость для реакции, протекающей между газообразными или жидкими реагентами в гомогенной (однородной) смеси в сосуде постоянного объема. В этом случае скорость реакции определяется как изменение концентрации любого из участвующих в реакции веществ (это может быть исходное вещество или продукт реакции) в единицу времени. Это определение можно записать в виде производной: v = dc/dt, где v – скорость реакции; t – временя, c – концентрация. Эту скорость легко определить, если есть экспериментальные данные по зависимости концентрации вещества от времени. По этим данным можно построить график, который называется кинетической кривой. Скорость реакции в заданной точке кинетической кривой определяется наклоном касательной в этой точке. Определение наклона касательной всегда связано с некоторой ошибкой. Точнее всего определяется начальная скорость реакции, поскольку вначале кинетическая кривая обычно близка к прямой; это облегчает проведение касательной в начальной точке кривой.
Если время измерять в секундах, а концентрацию – в молях на литр, то скорость реакции измеряется в единицах моль/(л·с). Таким образом, скорость реакции не зависит от объема реакционной смеси: при одинаковых условиях она будет одинаковой и в маленькой пробирке, и в многотоннажном реакторе.
Величина dt всегда положительна, тогда как знак dc зависит от того, как изменяется со временем концентрация – уменьшается (для исходных веществ) или увеличивается (для продуктов реакции). Чтобы скорость реакции всегда оставалась величиной положительной, в случае исходных веществ перед производной ставят знак минус: v = –dc/dt. Если реакция идет в газовой фазе, вместо концентрации веществ в уравнении скорости часто используют давление. Если газ близок к идеальному, то давление р связано с концентрацией с простым уравнением: p = cRT.
В ходе реакции разные вещества могут расходоваться и образовываться с разной скоростью, в соответствии с коэффициентами в стехиометрическом уравнении (см. СТЕХИОМЕТРИЯ), поэтому, определяя скорость конкретной реакции, следует учитывать эти коэффициенты. Например, в реакции синтеза аммиака 3H2 + N2 → 2NH3 водород расходуется в 3 раза быстрее, чем азот, а аммиак накапливается в 2 раза быстрее, чем расходуется азот. Пэтому уравнение скорости для этой реакции записывают следующим образом: v = –1/3 dp(H2)/dt = –dp(N2)/dt = +1/2 dp(NH3)/dt. В общем случае, если реакция стехиометрическая, т.е. протекает точно в соответствии с записанным уравнением: aA + bB → cC + dD, ее скорость определяют как v = –(1/a)d[A]/dt = –(1/b)d[B]/dt = (1/c)d[C]/dt = (1/d)d[D]/dt (квадратными скобками принято указывать молярную концентрацию веществ). Таким образом, скорости по каждому веществу жестко связаны между собой и, определив экспериментально скорость для любого участника реакции, легко рассчитать ее для любого другого вещества.
Большинство реакций, используемых в промышленности, относятся к гетерогенно-каталитическим. Они протекают на поверхности раздела фаз между твердым катализатором и газовой или жидкой фазой. На поверхности раздела двух фаз протекают и такие реакции как обжиг сульфидов, растворение металлов, оксидов и карбонатов в кислотах, ряд других процессов. Для таких реакций скорость зависит и от величины поверхности раздела, поэтому скорость гетерогенной реакции относят не к единице объема, а к единице поверхности. Измерить величину поверхности, на которой идет реакция, не всегда просто.
Если реакция протекает в замкнутом объеме, то ее скорость в большинстве случаев максимальна в начальный момент времени (когда максимальна концентрация исходных веществ), а затем, по мере превращения исходных реагентов в продукты и, соответственно, снижения их концентрации, скорость реакции уменьшается. Встречаются и реакции, в которых скорость увеличивается со временем. Например, если медную пластинку опустить в раствор чистой азотной кислоты, то скорость реакции будет расти со временем, что легко наблюдать визуально. Ускоряются со временем также процессы растворения алюминия в растворах щелочей, окисления многих органических соединений кислородом, ряд других процессов. Причины такого ускорения могут быть разными. Например, это может быть связано с удалением защитной оксидной пленки с поверхности металла, или с постепенным разогревом реакционной смеси, или с накоплением веществ, ускоряющих реакцию (такие реакции называются автокаталитическими).
В промышленности реакции обычно проводят путем непрерывной подачи в реактор исходных веществ и вывода продуктов. В таких условиях можно добиться постоянной скорости протекания химической реакции. С постоянной скоростью протекают и фотохимические реакции при условии полного поглощения падающего света (см. ФОТОХИМИЧЕСКИЕ РЕАКЦИИ).
Лимитирующая стадия реакции.
Если реакция осуществляется путем последовательно протекающих стадий (не обязательно все из них являются химическими) и одна из этих стадий требует значительно большего времени, чем остальные, то есть идет намного медленнее, то такая стадия называется лимитирующей. Именно эта самая медленная стадия определяет скорость всего процесса. Рассмотрим в качестве примера каталитическую реакцию окисления аммиака. Здесь возможны два предельных случая.
1. Поступление молекул реагентов – аммиака и кислорода к поверхности катализатора (физический процесс) происходит значительно медленнее, чем сама каталитическая реакция на поверхности. Тогда для повышения скорости образования целевого продукта – оксида азота совершенно бесполезно повышать эффективность катализатора, а надо позаботиться об ускорении доступа реагентов к поверхности.
2. Подача реагентов к поверхности происходит значительно быстрее самой химической реакции. Вот здесь имеет смысл совершенствовать катализатор, подбирать оптимальные условия для каталитической реакции, так как лимитирующей стадией в данном случае является каталитическая реакция на поверхности.
Теория столкновений.
Исторически первой теорией, на основании которой можно было рассчитывать скорости химических реакций, была теория столкновений. Очевидно, что для того, чтобы молекулы прореагировали, они прежде всего должны столкнуться. Отсюда следует, что реакция должна идти тем быстрее, чем чаще сталкиваются друг с другом молекулы исходных веществ. Поэтому каждый фактор, влияющий на частоту столкновений между молекулами, будет влиять и на скорость реакции. Некоторые важные закономерности, касающиеся столкновений между молекулами, были получены на основании молекулярно-кинетической теории газов.
В газовой фазе молекулы движутся с большими скоростями (сотни метров в секунду) и очень часто сталкиваются друг с другом. Частота столкновений определяется прежде всего числом частиц в единице объема, то есть концентрацией (давлением). Частота столкновений зависит также и от температуры (с ее повышением молекулы движутся быстрее) и от размера молекул (большие молекулы сталкиваются друг с другом чаще, чем маленькие). Однако концентрация влияет на частоту столкновений значительно сильнее. При комнатной температуре и атмосферном давлении каждая молекула средних размеров испытывает в секунду несколько миллиардов столкновений.
На основании этих данных можно рассчитать скорость реакции А + В → С между двумя газообразными соединениями А и В, предполагая, что химическая реакция проходит при каждом столкновении молекул реагентов. Пусть в литровой колбе при атмосферном давлении есть смесь реагентов А и В при равных концентрациях. Всего в колбе будет 6·1023/22,4 = 2,7·1022 молекул, из которых 1,35·1022 молекул вещества А и столько же молекул вещества В. Пусть за 1 с каждая молекула А испытывает 109 столкновений с другими молекулами, из которых половина (5·108) приходится на столкновения с молекулами В (столкновения А + А не приводят к реакции). Тогда всего в колбе за 1 с происходит 1,35·1022·5·108 ~ 7·1030 столкновений молекул А и В. Очевидно, что если бы каждое из них приводило к реакции, она прошла бы мгновенно. Однако многие реакции идут достаточно медленно. Отсюда можно сделать вывод, что лишь ничтожная доля столкновений между молекулами реагентов приводит к взаимодействию между ними.
Для создания теории, которая позволяла бы рассчитать скорость реакции на основании молекулярно-кинетической теории газов, нужно было уметь рассчитывать общее число столкновений молекул и долю «активных» столкновений, приводящих реакции. Нужно было также объяснить, почему скорость большинства химических реакций сильно возрастает при повышении температуры – скорость молекул и частота столкновений между ними увеличиваются с температурой незначительно – пропорционально 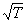 , то есть всего в 1,3 раза при повышении температуры от 293 К (20° С) до 373 К (100° С), тогда как скорость реакции при этом может увеличиться в тысячи раз.
, то есть всего в 1,3 раза при повышении температуры от 293 К (20° С) до 373 К (100° С), тогда как скорость реакции при этом может увеличиться в тысячи раз.
Эти проблемы были решены на основании теории столкновений следующим образом. При столкновениях молекулы непрерывно обмениваются скоростями и энергиями. Так, данная молекула в результате «удачного» столкновения может заметно увеличить свою скорость, тогда как при «неудачном» столкновении она может почти остановиться (похожую ситуацию можно наблюдать на примере бильярдных шаров). При нормальном атмосферном давлении столкновения, а следовательно, изменения скорости происходят с каждой молекулой миллиарды раз в секунду. При этом скорости и энергии молекул в значительной степени усредняются. Если в данный момент времени «пересчитать» в заданном объеме газа молекулы, обладающие определенными скоростями, то окажется, что значительная часть их имеет скорость, близкую к средней. В то же время многие молекулы обладают скоростью меньше средней, а часть движется со скоростями больше средней. С увеличением скорости доля молекул, имеющих данную скорость, быстро уменьшается. В соответствии с теорией столкновений, реагируют только те молекулы, которые при столкновении обладают достаточно высокой скоростью (и, следовательно, большим запасом кинетической энергии). Такое предположение было сделано в 1889 году шведским химиком Сванте Аррениусом.
Энергия активации.
Аррениус ввел в обиход химиков очень важное понятие энергии активации (Ea) – это та минимальная энергия, которой должна обладать молекула (или пара реагирующих молекул), чтобы вступить в химическую реакцию. Энергию активации измеряют обычно в джоулях и относят не к одной молекуле (это очень маленькая величина), а к молю вещества и выражают в единицах Дж/моль или кДж/моль. Если энергия сталкивающихся молекул меньше энергии активации, то реакция не пойдет, а если равна или больше, то молекулы прореагируют.
Энергии активации для разных реакций определяют экспериментально (из зависимости скорости реакции от температуры). Изменяться энергия активации может в довольно широких пределах – от единиц до нескольких сотен кДж/моль. Например, для реакции 2NO2 → N2O4 энергия активации близка к нулю, для реакции 2Н2О2 → 2Н2О + О2 в водных растворах Ea = 73 кДж/моль, для термического разложения этана на этилен и водород Ea = 306 кДж/моль.
Энергия активации большинства химических реакций значительно превышает среднюю кинетическую энергию молекул, которая при комнатной температуре составляет всего лишь около 4 кДж/моль и даже при температуре 1000° С не превышает 16 кДж/моль. Таким образом, чтобы прореагировать, молекулы обычно должны иметь скорость значительно больше средней. Например, в случае Ea = 200 кДж/моль сталкивающиеся молекулы небольшой молекулярной массы должны иметь скорость порядка 2,5 км/с (энергия активации в 25 раз больше средней энергии молекул при 20° С). И это – общее правило: для большинства химических реакций энергия активации значительно превышает среднюю кинетическую энергию молекул.
Вероятность для молекулы запасти в результате серии столкновений большую энергию очень мала: такой процесс требует для нее колоссального числа последовательных «удачных» столкновений, в результате которых молекула только набирает энергию, не теряя ее. Поэтому для многих реакций лишь ничтожная доля молекул имеет энергию, достаточную для преодоления барьера. Эта доля, в соответствии с теорией Аррениуса, определяется формулой: a = e–Ea/RT = 10–Ea/2,3RT ~ 10–Ea/19Т, где R = 8,31 Дж/(моль.К). Из формулы следует, что доля молекул, обладающих энергией Ea, как и доля активных столкновений a, очень сильно зависит как от энергии активации, так и от температуры. Например, для реакции с Ea = 200 кДж/моль при комнатной температуре (Т ~ 300 К) доля активных столкновений ничтожно мала: a = 10–200000/(19,300) ~ 10–35. И если каждую секунду в сосуде происходит 7·1030 столкновений молекул А и В, то понятно, что реакция идти не будет.
Если увеличить вдвое абсолютную температуру, т.е. нагреть смесь до 600 К (327° С); при этом доля активных столкновений резко возрастет: a = 10–200000/(19,600) ~ 4·10–18. Таким образом, повышение температуры в 2 раза увеличило долю активных столкновений в 4·1017 раз. Теперь каждую секунду из общего числа примерно 7·1030 столкновений к реакции будет приводить 7·1030·4·10–18 ~ 3·1013. Такая реакция, в которой каждую секунду исчезает 3·1013 молекул (из примерно 1022), хотя и очень медленно, но все же идет. Наконец, при температуре 1000 К (727° C) a ~ 3·10–11 (из каждых 30 миллиардов столкновений данной молекулы реагента одно приводит к реакции). Это уже много, так как за 1 с в реакцию будут вступать 7·1030·3·10–11 = 2·1020 молекул, и такая реакция пройдет за несколько минут (с учетом снижения частоты столкновений с уменьшением концентрации реагентов).
Теперь понятно, почему повышение температуры может так сильно увеличить скорость реакции. Средняя скорость (и энергия) молекул с повышением температуры увеличивается незначительно, но зато резко повышается доля «быстрых» (или «активных») молекул, обладающих достаточной для протекания реакции скоростью движения или достаточной колебательной энергией.
Расчет скорости реакции с учетом общего числа столкновений и доли активных молекул (т.е. энергии активации), часто дает удовлетворительное соответствие с экспериментальными данными. Однако для многих реакций наблюдаемая на опыте скорость оказывается меньше рассчитанной по теории столкновений. Это объясняется тем, что для осуществления реакции нужно, чтобы столкновение было удачным не только энергетически, но и «геометрически», то есть молекулы должны в момент столкновения определенным образом ориентироваться относительно друг друга. Таким образом, при расчетах скорости реакций по теории столкновений, помимо энергетического, учитывают и стерический (пространственный) фактор для данной реакции.
Уравнение Аррениуса.
Зависимость скорости реакции от температуры обычно описывают уравнением Аррениуса, которое в простейшем виде можно записать как v = v0 a = v0e–Ea/RT, где v0 – скорость, которую имела бы реакция при нулевой энергии активации (фактически это частота столкновений в единице объеме). Поскольку v0 слабо зависит от температуры, все определяет второй сомножитель – экспоненциальный: с увеличением температуры этот сомножитель быстро увеличивается, причем тем быстрее, чем больше энергия активации Еа. Указанная зависимость скорости реакции от температуры называется уравнением Аррениуса, оно – одно из важнейших в химической кинетике. Для приблизительной оценки влияния температуры на скорость реакции иногда используют так называемое «правило Вант-Гоффа» (см. ВАНТ-ГОФФА ПРАВИЛО).
Если реакция подчиняется уравнению Аррениуса, логарифм ее скорости (измеренной, например, в начальный момент) должен линейно зависеть от абсолютной температуры, то есть график зависимости lnv от 1/Т должен быть прямолинейным. Наклон этой прямой равен энергии активации реакции. По такому графику можно предсказать, какова будет скорость реакции при данной температуре или же – при какой температуре реакция будет идти с заданной скоростью.
Несколько практических примеров использования уравнения Аррениуса.
1. На упаковке замороженного продукта написано, что его можно хранить на полке холодильника (5° С) в течение суток, в морозильнике, отмеченном одной звездочкой (–6° С), – неделю, двумя звездочками (–12° С) – месяц, а в морозильнике со значком *** (что означает температуру в нем –18° С) – 3 месяца. Предположив, что скорость порчи продукта обратно пропорциональна гарантийному сроку хранения tхр, в координатах lntхр, 1/Т получаем, в соответствии с уравнением Аррениуса, прямую. Из нее можно рассчитать энергию активации биохимических реакций, приводящие к порче данного продукта (около 115 кДж/моль). Из того же графика можно выяснить, до какой температуры надо охладить продукт, чтобы его можно было хранить, например, 3 года; получается –29° С.
2. Альпинисты знают, что в горах трудно сварить яйцо, и вообще любую пищу, требующую более или менее длительного кипячения. Качественно причина этого понятна: с понижением атмосферного давления уменьшается температура кипения воды. С помощью уравнения Аррениуса можно рассчитать, сколько времени потребуется, например, чтобы сварить вкрутую яйцо в г. Мехико, расположенном на высоте 2265 м, где нормальным считается давление 580 мм рт.ст., а вода при таком пониженном давлении кипит при 93° С. Энергия активации реакция «свертывания» (денатурации) белка была измерена и оказалась очень большой по сравнению со многими другими химическими реакциями – порядка 400 кДж/моль (она может несколько отличаться для различных белков). В таком случае понижение температуры от 100 до 93° С (то есть от 373 до 366 К) приведет к замедлению реакции в 10(400000/19)(1/366 – 1/373) = 11,8 раза. Именно поэтому жители высокогорья предпочитают варке пищи ее жарку: температура сковородки, в отличие от температуры кастрюли с кипятком, не зависит от атмосферного давления.
3. В кастрюле-скороварке пища готовится при повышенном давлении и, следовательно, при повышенной температуре кипения воды. Известно, что в обычной кастрюле говядина варится 2–3 часа, а компот из яблок – 10–15 мин. Учитывая, что оба процесса имеют близкую энергию активации (около 120 кДж/моль), можно по уравнению Аррениуса рассчитать, что в скороварке при 118°С мясо будет вариться 25–30 мин, а компот – всего 2 мин.
Уравнение Аррениуса очень важно для химической промышленности. При протекании экзотермической реакции выделяющаяся тепловая энергия нагревает не только окружающую среду, но и сами реагенты. это может привести к нежелательному сильному ускорению реакции. Расчет изменения скорости реакции и скорости тепловыделения при повышении температуры позволяет избежать теплового взрыва (см. ВЗРЫВЧАТЫЕ ВЕЩЕСТВА).
Зависимость скорости реакции от концентрации реагентов.
Скорость большинства реакций со временем постепенно снижается. Этот результат хорошо согласуется с теорией столкновений: по мере протекания реакции концентрации исходных веществ падают, снижается и частота столкновений между ними; соответственно уменьшается и частота столкновения активных молекул. Это приводит к уменьшению скорости реакции. В этом состоит сущность одного из основных законов химической кинетики: скорость химической реакции пропорциональна концентрации реагирующих молекул. Математически это можно записать в виде формулы v = k[A][B], где k – постоянная, называемая константой скорости реакции. Приведенное уравнение называется уравнением скорости химической реакции или кинетическим уравнением. Константа скорости для данной реакции не зависит от концентрации реагентов и от времени, но она зависит от температуры в соответствии с уравнением Аррениуса: k = k0e–Ea/RT.
Простейшее уравнение скорости v = k[A][B] всегда справедливо в том случае, когда молекулы (или другие частицы, например, ионы) А, сталкиваясь с молекулами В, могут непосредственно превращаться в продукты реакции. Подобные реакции, идущие в один прием (как говорят химики, в одну стадию), называются элементарными реакциями. Таких реакций немного. Большинство реакций (даже таких с виду таких простых как H2 + I2 ® 2HI) не являются элементарными, поэтому исходя из стехиометрического уравнения такой реакции записать его кинетическое уравнение нельзя.
Кинетическое уравнение можно получить двумя способами: экспериментально – измеряя зависимость скорости реакции от концентрации каждого реагента по отдельности, и теоретически – если известен детальный механизм реакции. Чаще всего (но не всегда) кинетическое уравнение имеет вид v = k[A]x[B]y, где x и y называются порядками реакции по реагентам А и В. Эти порядки, в общем случае, могут быть целыми и дробными, положительными и даже отрицательными. Например, кинетическое уравнение для реакции термического распада ацетальдегида CH3CHO ® CH4 + CO имеет вид v = k[CH3CHO]1,5, т.е. реакция имеет полуторный порядок. Иногда возможно случайное совпадение стехиометрических коэффициентов и порядков реакции. Так, эксперимент показывает, что реакция H2 + I2 ® 2HI имеет первый порядок как по водороду, так и по иоду, то есть ее кинетическое уравнение имеет вид v = k[H2][I2] (именно поэтому эту реакцию в течение многих десятилетий считали элементарной, пока в 1967 не был доказан ее более сложный механизм).
Если известно кинетическое уравнение, т.е. известно, как скорость реакции зависит от концентраций реагентов в каждый момент времени, и известна константа скорости, то можно рассчитать зависимость от времени концентраций реагентов и продуктов реакции, т.е. теоретически получить все кинетические кривые. Для таких расчетов используются методы высшей математики или компьютерные расчеты, и они не представляют принципиальных трудностей.
С другой стороны, полученное экспериментально кинетическое уравнение помогает судить о механизме реакции, т.е. о совокупности простых (элементарных) реакций. Выяснение механизмов реакций является важнейшей задачей химической кинетики. Это очень трудная задача, так как механизм даже простой с виду реакции может включать множество элементарных стадий.
Можно проиллюстрировать применение кинетических методов для определения механизма реакции на примере щелочного гидролиза алкилгалогенидов с образованием спиртов: RX + OH– → ROH + X–. Экспериментально было обнаружено, что для R = CH3, C2H5 и т.д. и X = Cl скорость реакции прямо пропорционально концентрациям реагентов, т.е. имеет первый порядок по галогениду RX и первый – по щелочи, и кинетическое уравнение имеет вид v = k1[RX][OH–]. В случае третичных алкилиодидов (R = (CH3)3C, X = I) порядок по RX – первый, а по щелочи – нулевой: v = k2[RX]. В промежуточных случаях, например, для изопропилбромида (R = (CH3)2CH, X = Br), реакция описывается более сложным кинетическим уравнением: v = k1[RX][OH–] + k2[RX]. На основании этих кинетических данных был сделан следующий вывод о механизмах подобных реакций.
В первом случае реакция идет в один прием, путем непосредственного столкновения молекул спирта с ионами ОН– (так называемый механизм SN2). Во втором случае реакция идет в две стадии. Первая стадия – медленная диссоциация алкилиодида на два иона: RI → R+ + I–. Вторая – очень быстрая реакция между ионами: R+ + OH– → ROH. Скорость суммарной реакции зависит только от медленной (лимитирующей) стадии, поэтому она не зависит от концентрации щелочи; отсюда – нулевой порядок по щелочи (механизм SN1). В случае вторичных алкилбромидов осуществляются одновременно оба механизма, поэтому кинетическое уравнение более сложное.
Илья Леенсон
История учения о химическом процессе. М., Наука, 1981
Леенсон И.А. Химические реакции. М., АСТ – Астрель, 2002
Ответь на вопросы викторины «Неизвестные подробности»