КАЛИЙ
КАЛИЙ (Kalium) K, химический элемент 1 (Ia) группы Периодической системы, относится к щелочным элементам. Атомный номер 19, атомная масса 39,0983. Состоит из двух стабильных изотопов 39K (93,259%) и 41K (6,729%), а также радиоактивного изотопа 40K с периодом полураспада ~109 лет. Этот изотоп играет в природе особую роль. Его доля в смеси изотопов составляет всего 0,01%, однако именно он является источником практически всего содержащегося в земной атмосфере аргона 40Ar, который образуется при радиоактивном распаде 40K. Кроме того, 40K присутствует во всех живых организмах, что, возможно, оказывает определенное влияние на их развитие.
Изотоп 40K служит для определения возраста горных пород калий-аргоновым методом. Искусственный изотоп 42K с периодом полураспада 15,52 года используется в качестве радиоактивного индикатора в медицине и биологии.
Степень окисления +1.
Соединения калия известны с древних времен. Поташ – карбонат калия K2CO3 – издавна выделяли из древесной золы.
Металлический калий был получен электролизом расплавленного едкого кали (KOH) в 1807 английским химиком и физиком Гемфри Дэви. Название «potassium», выбранное Дэви, отражает происхождение этого элемента из поташа. Латинское название элемента образовано от арабского названия поташа – «аль-кали». В русскую химическую номенклатуру слово «калий» введено в 1831 петербургским академиком Германом Гессом (1802–1850).
Распространение калия в природе и его промышленное извлечение.
Содержание калия в земной коре составляет 1,84%. Он – следующий по распространенности элемент после натрия. В литосфере калий находится, главным образом, в виде алюмосиликатов, например, полевого шпата ортоклаза K2O·Al2O3·6SiO2, на долю которого приходится почти 18% массы земной коры.
Большие отложения солей калия в сравнительно чистом виде образовались в результате испарения древних морей. Наиболее важными минералами калия для химической промышленности являются сильвин (KCl) и сильвинит (смешанная соль NaCl и KCl). Калий встречается также в виде двойного хлорида KCl·MgCl2·6H2O (карналлит) и сульфата K2Mg2(SO4)3 (лангбейнит). Массивные слои солей калия были впервые обнаружены в Стассфурте (Германия) в 1856. Из них с 1861 по 1972 в промышленных масштабах добывали поташ.
Океанская вода содержит около 0,06% хлорида калия. В некоторых внутренних водоемах, таких как озеро Солт-Лейк или Мертвое море, его концентрация может достигать 1,5%, что делает экономически целесообразной добычу элемента. В Иордании построен огромный завод, способный добывать миллионы тонн солей калия из Мертвого моря.
Хотя натрий и калий почти одинаково распространены в горных породах, в океане калия примерно в 30 раз меньше, чем натрия. Это связано, в частности, с тем, что соли калия, содержащие больший катион, менее растворимы, чем соли натрия, и калий более прочно связывается в комплексных силикатах и алюмосиликатах в почве за счет ионного обмен в глинах. Кроме того, калий, который выщелачивается из горных пород, в большей степени поглощается растениями. Подсчитано, что из тысячи атомов калия, освобождающихся при химическом выветривании, только два достигают морских бассейнов, а 998 остаются в почве. «Почва поглощает калий, и в этом ее чудодейственная сила», – писал академик Александр Евгеньевич Ферсман (1883–1945).
Калий является важным элементом жизни растений, и развитие диких растений часто ограничивается доступностью калия. При недостатке калия растения медленнее растут, их листья, особенно старые, желтеют и буреют по краям, стебель становится тонким и непрочным, а семена теряют всхожесть. Плоды такого растения – это особенно заметно на фруктах – будут менее сладкими, чем у растений, получивших нормальную дозу калия. Недостаток калия возмещают удобрениями.
Калийные удобрения являются основным видом калиесодержащей продукции (95%). Больше всего используется KCl, на его долю приходится более 90% калия, используемого в качестве удобрений.
Мировое производство калийных удобрений в 2003 оценено в 27,8 млн т (в пересчете на K2O, содержание калия в калийных удобрениях принято пересчитывать на K2O). Из них 33% было произведено в Канаде. По 13% мирового производства калийных удобрений приходится на производственные объединения «Уралкалий» и «Беларуськалий».
Характеристика простого вещества и промышленное получение металлического калия.
Калий – мягкий серебристо-белый металл с температурой плавления 63,51° С и температурой кипения 761° С. Придает пламени характерную красно-фиолетовую окраску, что связано с легкостью возбуждения его внешних электронов.
Химически очень активен, легко взаимодействует с кислородом, при нагревании на воздухе загорается. Основным продуктом этой реакции является надпероксид калия KO2.
С водой и разбавленными кислотами калий взаимодействует со взрывом и воспламенением. Серную кислоту восстанавливает до сероводорода, серы и диоксида серы, а азотную – до оксидов азота и N2.
При нагревании до 200–350° С калий реагирует с водородом с образованием гидрида KH. Металлический калий воспламеняется в атмосфере фтора, слабо взаимодействует с жидким хлором, но взрывается при соприкосновении с бромом и растирании с иодом. Калий реагирует с халькогенами и фосфором. С графитом при 250–500° С он образует слоистые соединения состава C8K–C60K.
Калий растворяется в жидком аммиаке (35,9 г в 100 мл при –70° С) с образованием ярко-голубых метастабильных растворов с необычными свойствами. Впервые это явление наблюдал, по-видимому, сэр Гемфри Дэви в 1808. Растворы калия в жидком аммиаке широко изучались с того момента, как они были получены Т.Вейлем в 1863.
Калий не растворяется в жидких литии, магнии, кадмии, цинке, алюминии и галлии и не реагирует с ними. С натрием образует интерметаллическое соединение KNa2, которое плавится с разложением при 7° С. С рубидием и цезием калий дает твердые растворы с минимальными температурами плавления около 35° С. С ртутью он образует амальгаму, содержащую два меркурида KHg2 и KHg с температурами плавления 270 и 180° С, соответственно.
Калий энергично взаимодействует со многими оксидами, восстанавливая их до простых веществ. Со спиртами он образует алкоголяты.
В отличие от натрия, калий не удается получать электролизом расплава хлорида, так как калий очень хорошо растворяется в расплавленном хлориде и не всплывает на поверхность. Дополнительную трудность создает образование надпероксида, который реагирует с металлическим калием с взрывом, поэтому способ промышленного производства металлического калия заключается в восстановлении расплавленного хлорида калия металлическим натрием при 850° С.
Восстановление хлорида калия натрием, на первый взгляд, противоречит обычному порядку реакционной способности (калий более реакционноспособен, чем натрий). Однако, при 850–880° С устанавливается равновесие:
Так как калий более летуч, он испаряется раньше, это смещает равновесие и способствует протеканию реакции. Фракционной перегонкой в насадочной колонне можно получить калий 99,5%-ной чистоты, но обычно для перевозки используют смесь калия с натрием. Сплавы, содержащие 15–55% натрия, являются (при комнатной температуре) жидкими, поэтому их легче транспортировать.
Иногда калий восстанавливают из хлорида другими элементами, образующими устойчивые оксиды:
6KCl + 2Al + 4CaO = 3CaCl2 + CaO·Al2O3 + 6K
Металлический калий, производство которого является более трудным и дорогим, чем производство натрия, вырабатывается в гораздо меньших количествах (мировое производство составляет около 500 т в год). Одна из важнейших областей применения – получение надпероксида KO2 прямым сжиганием металла.
Металлический калий используют как катализатор в производстве некоторых видов синтетического каучука, а также в лабораторной практике. Сплав калия с натрием служит теплоносителем в атомных реакторах. Он же является восстановителем в производстве титана.
Калий вызывает сильные ожоги кожи. При попадании даже мельчайших его крошек в глаза возможна потеря зрения. Загоревшийся калий заливают минеральным маслом или засыпают смесью талька и хлорида натрия.
Хранят калий в герметически закрытых коробках под слоем обезвоженного керосина или минерального масла. Отходы калия утилизируют обработкой их сухим этанолом или пропанолом с последующим разложением образовавшихся алкоголятов водой.
Соединения калия.
Калий образует многочисленные бинарные соединения и соли. Почти все соли калия хорошо растворимы. Исключениями являются:
KHC4H4O6 – гидротартрат калия
KClO4 – перхлорат калия
K2Na[Co(NO2)6]·6H2O – гидрат гексанитрокобальтата(III) натрия-дикалия
K2[PtCl6] – гексахлороплатинат(IV) калия
Оксид калия K2O образует желтоватые кристаллы. Его получают при нагревании калия с гидроксидом, пероксидом, нитратом или нитритом калия:
2KNO2 + 6K = 4K2O + N2
Используют также нагревание смеси азида калия KN3 и нитрита калия или окисление калия, растворенного в жидком аммиаке, рассчитанным количеством кислорода.
Оксид калия – активатор губчатого железа, которое используется как катализатор в синтезе аммиака.
Пероксид калия K2O2 получить из простых веществ сложно, так как он легко окисляется до надпероксида KО2, оэтому используют окисление металла с помощью NO. Однако наилучшим методом его получения является количественное окисление металла, растворенного в жидком аммиаке.
Пероксид калия можно рассматривать как соль двухосновной кислоты Н2О2. Поэтому при его взаимодействии с кислотами или водой на холоде количественно образуется пероксид водорода.
Надпероксид калия KO2 (оранжевый) образуется при обычном сжигании металла на воздухе. Это соединение используется как запасной источник кислорода в дыхательных масках в шахтах, подводных лодках и космических кораблях.
При осторожном термическом разложении KO2 образуется полуторный оксид «K2О3» в виде темного парамагнитного порошка Его можно получить также окислением металла, растворенного в жидком аммиаке, или контролируемым окислением пероксида. Предполагается, что он является динадпероксид-пероксидом [(K+)4(O22–)(O2–)2].
Озонид калия KО3 можно получить при действии озона на безводный порошок гидроксида калия при низкой температуре с последующей экстракцией продукта (красного цвета) жидким аммиаком. Он используется в качестве компонента составов для регенерации воздуха в замкнутых системах.
Гидроксид калия KOH – сильное основание, относится к щелочам. Его традиционное название «едкое кали» отражает разъедающее действие этого вещества на живые ткани.
В промышленности гидроксид калия получают электролизом водных растворов хлорида или карбоната калия с железным или ртутным катодом (мировое производство составляет около 0,7 млн. т в год). Гидроксид калия можно выделить из фильтрата после отделения осадков, образующихся при взаимодействии карбоната калия с гидроксидом кальция или сульфата калия с гидроксидом бария.
Гидроксид калия применяют для получения жидкого мыла и различных соединений калия. Кроме того, он служит электролитом в щелочных аккумуляторах.
Фторид калия KF образует редкий минерал кароббиит. Получают фторид калия взаимодействием водных растворов фтороводорода или фторида аммония с гидроксидом калия или его солями.
Применяют фторид калия для синтеза различных фторсодержащих соединений калия, как фторирующий агент в органическом синтезе, а также как компонент кислотоупорных замазок и специальных стекол.
Хлорид калия KCl встречается в природе. Сырьем для его выделения служат сильвин, сильвинит, карналлит.
Из сильвинита хлористый калий получают методами галургии и флотации. Галургия (в переводе с греческого – «соляное дело») включает изучение состава и свойств природного солевого сырья и разработку способов промышленного получения из него минеральных солей. Галургический метод разделения основан на различной растворимости KCl и NaCl в воде при повышенных температурах. При нормальной температуре растворимость хлоридов калия и натрия почти одинакова. С повышением температуры растворимость хлорида натрия почти не меняется, а растворимость хлорида калия резко возрастает. На холоде готовят насыщенный раствор обеих солей, затем его нагревают и обрабатывают им сильвинит. При этом раствор дополнительно насыщается хлоридом калия, а часть хлорида натрия вытесняется из раствора, выпадает в осадок и отделяется фильтрованием. Раствор охлаждают, и из него выкристаллизовывается избыточный хлорид калия. Кристаллы отделяют на центрифугах и сушат, а маточный раствор идет на обработку новой порции сильвинита. Для выделения хлорида калия этот метод используется шире метода флотации, который базируется на разной смачиваемости веществ.
Хлорид калия является наиболее распространенным калийным удобрением. Кроме использования в качестве удобрений, он применяется, в основном, для производства гидроксида калия электролизом. Из него получают и другие соединения калия.
Бромид калия KBr получают взаимодействием брома с гидроксидом калия в присутствии аммиака, а также реакциями брома или бромидов с солями калия.
Бромид калия широко используется в фотографии. Он часто служит источником брома в органическом синтезе. Раньше бромид калия применялся как седативное средство в медицине («бром»). Монокристаллы бромида калия используют при изготовлении призм для ИК-спектрометров, а также в качестве матрицы при снятии ИК спектров твердых веществ.
Иодид калия KI образует бесцветные кристаллы, которые на свету приобретают желтоватую окраску за счет окисления кислородом воздуха и выделения иода. Поэтому иодид калия хранят в склянках из темного стекла.
Получают иодид калия взаимодействием иода с гидроксидом калия в присутствии муравьиной кислоты или пероксида водорода, а также обменными реакциями иодидов с солями калия. Он окисляется азотной кислотой до иодата калия KIO3. Иодид калия взаимодействует с иодом с образованием растворимого в воде комплекса K[I(I)2], а с хлором и бромом дает, соответственно, K[ICl2] и K[IBr2].
Иодид калия применяется в качестве лекарственного средства в медицине и ветеринарии. Он является реактивом в иодометрии. Иодид калия – противовуалирующее вещество в фотографии, компонент электролита в электрохимических преобразователях, добавка для повышения растворимости иода в воде и полярных растворителях, микроудобрение.
Сульфид калия K2S хорошо растворим в воде. При гидролизе создает в растворе щелочную среду:
K2S = 2K+ + S2–; S2– + H2O  HS– + OH–
HS– + OH–
Сульфид калия легко окисляется на воздухе, при поджигании сгорает. Получают его взаимодействием калия или карбоната калия с серой без доступа воздуха, а также восстановлением сульфата калия углеродом.
Сульфид калия является компонентом светочувствительных эмульсий в фотографии. Его используют как аналитический реагент для разделения сульфидов металлов и как компонент составов для обработки шкур.
При насыщении водного раствора сероводородом образуется гидросульфид калия KHS, который можно выделить в виде бесцветных кристаллов. Его применяют в аналитической химии для разделения тяжелых металлов.
Нагреванием сульфида калия с серой получают желтые или красные полисульфиды калия KSn (n = 2–6). Водные растворы полисульфидов калия можно получить кипячением растворов гидроксида или сульфида калия с серой. При спекании карбоната калия с избытком серы на воздухе образуется так называемая серная печень – смесь KSn и K2S2O3.
Применяют полисульфиды для сульфидирования стали и чугуна. Серная печень используется как лекарственное средство для лечения кожных заболеваний и как пестицид.
Сульфат калия K2SO4 встречается в природе в месторождениях калийных солей и в водах соленых озер. Его можно получить обменной реакцией между хлоридом калия и серной кислотой или сульфатами других элементов.
Сульфат калия применяют как удобрение. Это вещество более дорогое, чем хлорид калия, но не гигроскопичное и не слеживающееся, в отличие от хлорида калия, сульфат калия можно применять на любых почвах, в том числе и засоленных.
Из сульфата калия получают квасцы и другие соединения калия. Он входит в состав шихты в производстве стекла.
Нитрат калия KNO3 – сильный окислитель. Его часто называют калийной селитрой. В природе образуется при разложении органических веществ в результате жизнедеятельности нитрифицирующих бактерий.
Получают нитрат калия обменной реакцией между хлоридом калия и нитратом натрия, а также действием азотной кислоты или нитрозных газов на карбонат или хлорид калия.
Нитрат калия – отличное удобрение, содержащее одновременно калий и азот, однако применяется меньше, чем хлорид калия, из-за высокой стоимости производства. Нитрат калия используется и для изготовления черного пороха и пиротехнических составов, в производстве спичек и стекла. Кроме того, он применяется при консервировании мясных продуктов.
Карбонат калия K2CO3 называют также поташом. Получают при действии диоксида углерода на растворы гидроксида калия или суспензии карбоната магния в присутствии хлорида калия. Является побочным продуктом при переработке нефелина в глинозем.
Значительное количество карбоната калия содержится в растительной золе. Больше всего калия в золе подсолнечника – 36,3%. В золе дров оксида калия значительно меньше – от 3,2% (еловые дрова) до 13,8% (березовые дрова). Еще меньше калия в золе торфа.
Карбонат калия используется, главным образом, для производства высококачественного стекла, используемого в оптических линзах, трубках цветных телевизоров и флуоресцентных лампах. Применяется и в производстве фарфора, красителей и пигментов.
Перманганат калия KMnO4 образует темно-фиолетовые кристаллы. Растворы этого вещества имеют красно-фиолетовый цвет. Перманганат калия получают анодным окислением марганца или ферромарганца в сильно щелочной среде.
Перманганат калия – сильный окислитель. Его используют как обесцвечивающее, отбеливающее и очищающее средство. Применяется и в органическом синтезе, например, при производстве сахарина.
Гидрид калия KH – белое твердое вещество, при нагревании разлагается на простые вещества. Гидрид калия является сильнейшим восстановителем. Он воспламеняется во влажном воздухе и в среде фтора или хлора. Гидрид калия может быть окислен даже такими слабыми окислителями, как вода и диоксид углерода:
KH + H2O = KOH + H2
KH + CO2 = K(HCOO) (формиат калия)
Гидрид калия вступает также в реакции с кислотами и спиртами, при этом возможно воспламенение. Он восстанавливают сероводород, хлороводород и другие вещества, содержащие водород(I):
2KH + H2S = K2S + 2H2
KH + HCl = KCl + H2
Гидрид калия используется как восстановитель при проведении неорганических и органических синтезов.
Цианид калия KCN, известный под названием цианистый калий, образует бесцветные кристаллы, хорошо растворимые в воде и некоторых неводных растворителях. В водном растворе он постепенно гидролизуется с выделением циановодорода HCN, а при кипячении водных растворов разлагается на формиат калия и аммиак.
В присутствии цианида калия могут идти не совсем обычные реакции, например, медь реагирует с водой, выделяя из нее водород и образуя дицианокупрат(I) калия:
2Cu + 4KCN + 2H2O = 2K[Cu(CN)2] + H2
В подобных условиях идет взаимодействие и в случае золота. Правда, этот менее активный металл не способен окисляться водой, однако в присутствии кислорода переходит в раствор в виде цианокомплекса – дицианоаурата(I) калия:
4Au + 8KCN + 2H2O + O2 = 4K[Au(CN)2] + 4NaOH
Получают цианид калия взаимодействием циановодорода с избытком гидроксида калия. Он является реагентом для извлечения серебра и золота из бедных руд, компонентом электролитов для очистки платины от серебра и для гальванического золочения и серебрения. Цианид калия применяют как реактив в химическом анализе для определения серебра, никеля и ртути.
Цианид калия очень токсичен. Смертельная доза для человека 120 мг.
Комплексные соединения. Наиболее устойчивые комплексные соединения калий образует с полидентатными лигандами (молекулами или ионами, которые могут соединяться с атомом несколькими связями), например, с макроциклическими полиэфирами (краун-эфирами).
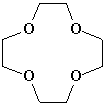
Краун-эфиры (от английского crown – корона) содержат в цикле свыше 11 атомов, из которых не менее четырех –атомы кислорода. В тривиальных названиях краун-эфиров общее число атомов в цикле и число атомов кислорода обозначают цифрами, которые ставят, соответственно, до и после слова «краун». Такие названия намного короче систематических. Например, 12-краун-4 (рис. 1) по международной номенклатуре называется 1,4,7,10,13-тетраоксоциклододекан.
Рис. 1. ГРАФИЧЕСКАЯ ФОРМУЛА соединения 12-краун-4.
Краун-эфиры образуют устойчивые комплексы с катионами металлов. При этом катион включается во внутримолекулярную полость краун-эфира и удерживается там благодаря ион-дипольному взаимодействию с атомами кислорода. Наиболее устойчивы комплексы с катионами, геометрические параметры которых соответствуют полости краун-эфира. С катионом калия наиболее устойчивые комплексы образуют краун-эфиры, содержащие 6 атомов кислорода, например, 18-краун-6 (рис. 2).
Рис. 2. ГРАФИЧЕСКАЯ ФОРМУЛА комплекса калия с 18-краун-6.
Биологическая роль калия (и натрия). Калий вместе с натрием регулируют процессы обмена веществ в живых организмах. В организме человека внутри клеток содержится большое количество ионов калия (0,12–0,16 моль/л), но относительно мало ионов натрия (0,01 моль/л). Содержание ионов натрия значительно выше во внеклеточной жидкости (около 0,12 моль/л), поэтому ионы калия контролируют внутриклеточную активность, а ионы натрия – межклеточную. Эти ионы не могут заменить друг друга.
Существование натрий-калиевого градиента с внутренней и внешней стороны клеточной мембраны приводит к возникновению разности потенциалов на противоположных сторонах мембраны. Нервные волокна способны передавать импульсы, а мышцы – сокращаться именно благодаря существованию внутреннего отрицательного заряда по отношению к внешней поверхности мембраны. Таким образом, в организме ионы натрия и калия осуществляют физиологический контроль и пусковые механизмы. Они способствуют передаче нервного импульса. Психика человека зависит от баланса ионов натрия и калия в организме. Концентрацию ионов натрия и калия, задерживаемых и выделяемых через почки, контролируют некоторые гормоны. Так, минералокортикоиды способствуют увеличению выброса ионов калия и уменьшению выброса ионов натрия.
Ионы калия входят в состав ферментов, катализирующих перенос (транспорт) ионов через биомембраны, окислительно-восстановительные и гидролитические процессы. Они служат и для поддержания структуры клеточных стенок и контролируют их состояние. Ион натрия активирует несколько ферментов, которые калий не может активировать, так же как ион натрия не может действовать на калиезависимые ферменты. Когда эти ионы попадают внутрь клетки, они связываются подходящими лигандами в соответствии с их химической активностью. Роль таких лигандов выполняют макроциклические соединения, модельными аналогами которых являются краун-эфиры. Некоторые антибиотики (подобные валиномицину) транспортируют ионы калия в митохондрии.
Установлено, что для работы (Na+–K+)–АТФ-азы (аденозинтрифосфатазы) – мембранного фермента, катализирующего гидролиз АТФ, нужны одновременно ионы натрия и калия. Транспортная АТФ-аза связывает и высвобождает ионы натрия и калия на определенных стадиях ферментативной реакции, поскольку сродство активных центров фермента к ионам натрия и калия изменяется по мере протекания реакции. При этом структурные изменения фермента этом приводят к тому, что катионы натрия и калия принимаются по одну сторону от мембраны, а высвобождаются по другую. Таким образом, одновременно с гидролизом АТФ происходит и селективное перемещение катионов щелочных элементов (работа так называемого Na–K-насоса).
Суточная потребность в калии у ребенка составляет 12–13 мг на 1 кг веса, а у взрослого – 2–3 мг, т.е. в 4–6 раз меньше. Большую часть необходимого ему калия человек получает из пищи растительного происхождения.
Елена Савинкина
Фигуровский Н.А. Открытие элементов и происхождение их названий. М., Наука, 1970
Популярная библиотека химических элементов. Под. ред. И.В.Петрянова-Соколова М., 1983
Greenwood N.N., Earnshaw A. Chemistry of the Elements, Oxford: Butterworth, 1997
Ответь на вопросы викторины «Неизвестные подробности»