ОРБИТАЛЬ
ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
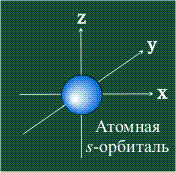
Электрон движется в атоме вокруг ядра не по фиксированной линии-орбите, а занимает некоторую область пространства. Например, электрон в атоме водорода может с определенной вероятностью оказаться либо весьма близко к ядру, либо на значительном удалении, однако существует определенная область, где его появление наиболее вероятно. Графически орбиталь изображают в виде поверхности, очерчивающей область, где вероятность появления электрона наибольшая, иначе говоря, электронная плотность максимальна. У атома водорода орбиталь электрона имеет сферическую (шаровую) форму:
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип. Формы орбиталей вычислены методами квантовой химии.
Орбитали существуют независимо от того, находится на них электрон (занятые орбитали), или отсутствует (вакантные орбитали). Атом каждого элемента, начиная с водорода и заканчивая последним полученным на сегодня элементом, имеет полный набор всех орбиталей на всех электронных уровнях. Их заполнение электронами происходит по мере увеличения порядкового номера, то есть, заряда ядра.
s-Орбитали, как было показано выше, имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат:
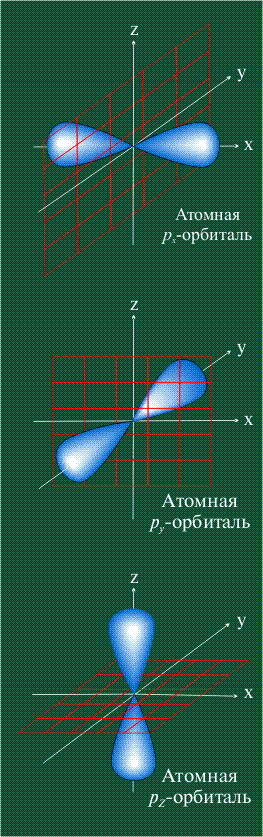
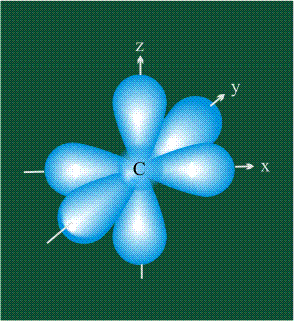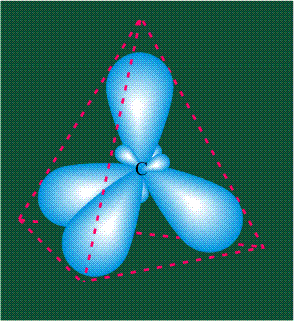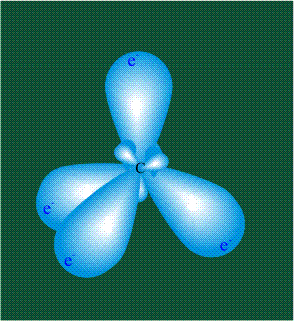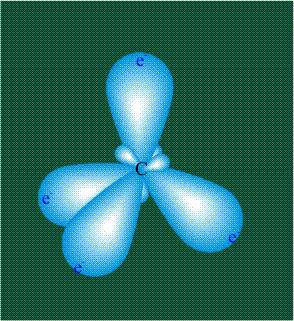
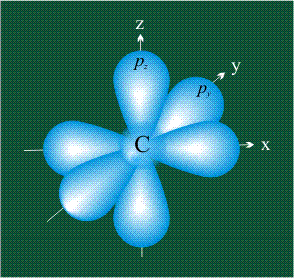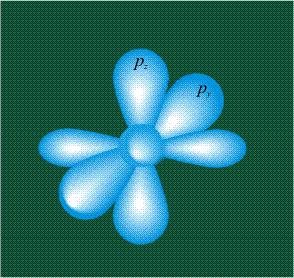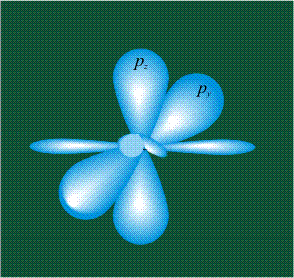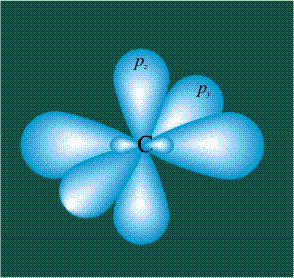
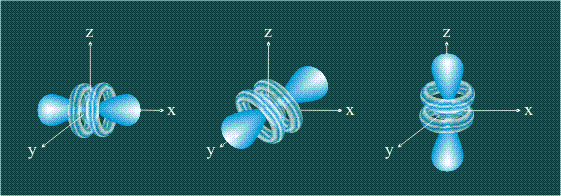
На первом электронном уровне каждого атома находится только одна s-орбиталь. Начиная со второго электронного уровня помимо s-орбитали появляются также три р-орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
В современной химии орбиталь – определяющее понятие, позволяющее рассматривать процессы образования химических связей и анализировать их свойства, при этом внимание сосредотачивают на орбиталях тех электронов, которые участвуют в образовании химических связей, то есть, валентных электронов, обычно это электроны последнего уровня.
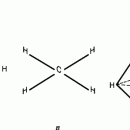
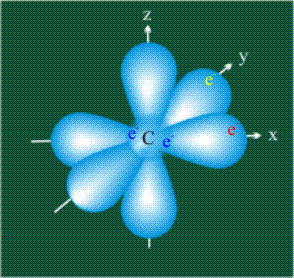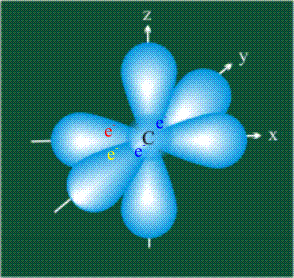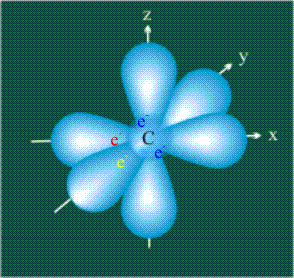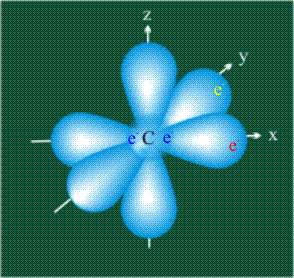
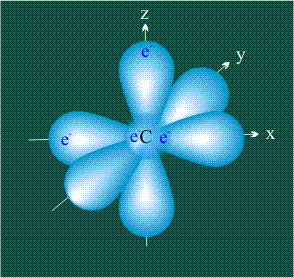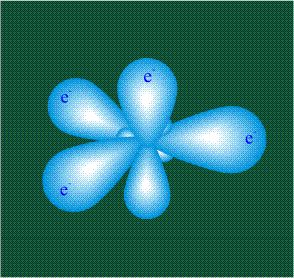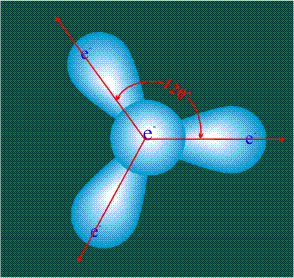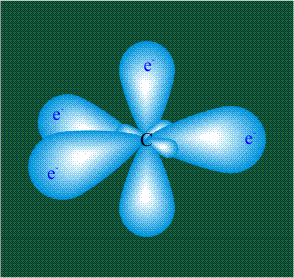
У атома углерода в исходном состоянии на втором (последнем) электронном уровне находится два электрона на s-орбитали (отмечены синим цветом) и по одному электрону на двух р-орбиталях (отмечены красным и желтым цветом), третья орбиталь – рz-вакантная:
Гибридизация.
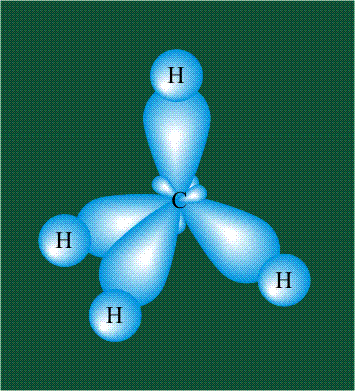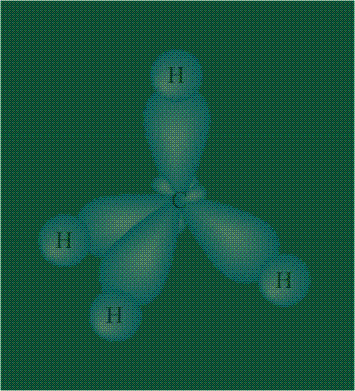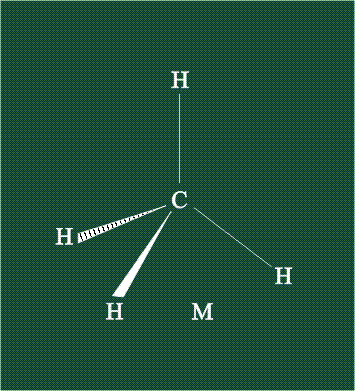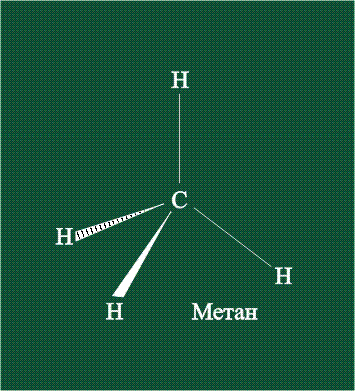
В том случае, когда атом углерода участвует в образовании насыщенных соединений (не содержащих кратных связей), одна s-орбиталь и три р-орбитали объединяются, образуя новые орбитали, представляющие собой гибриды исходных орбиталей (процесс называют гибридизацией). Количество гибридных орбиталей всегда равно количеству исходных, в данном случае, четыре. Получившиеся орбитали-гибриды одинаковы по форме и внешне напоминают асимметричные объемные восьмерки:
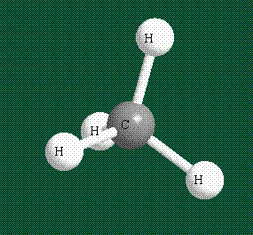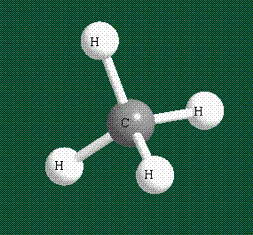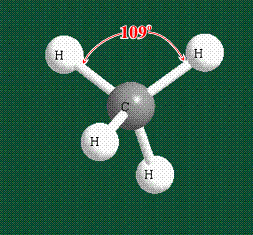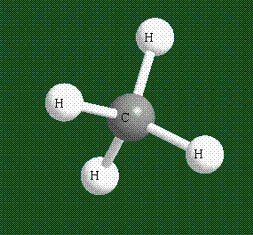
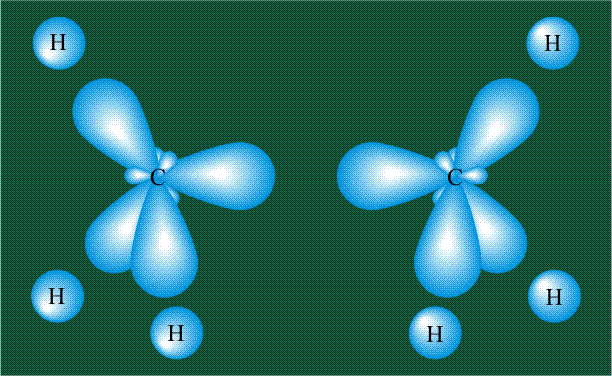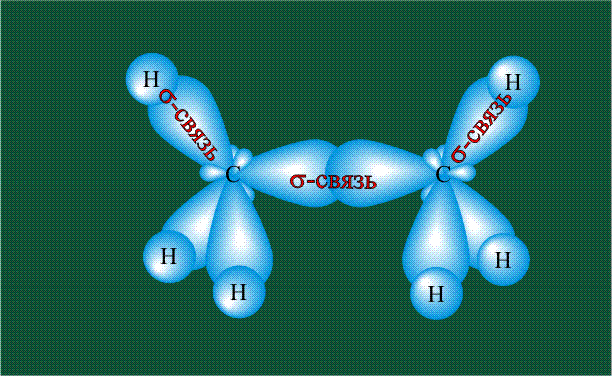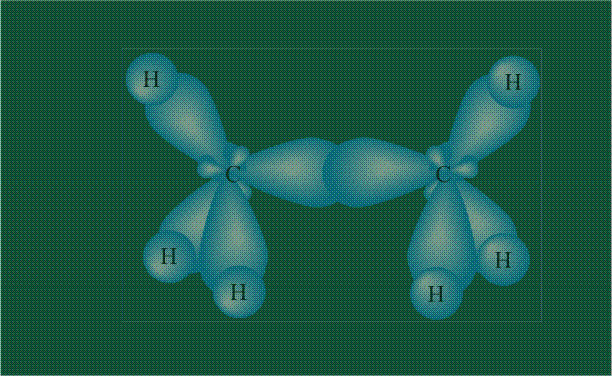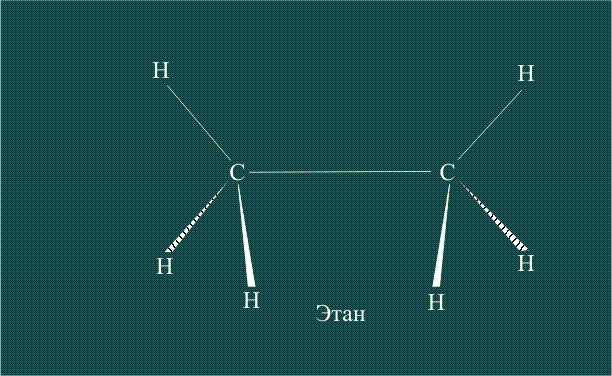
Вся конструкция оказывается как бы вписанной в правильный тетраэдр – призма, собранная из правильных треугольников. При этом орбитали-гибриды располагаются вдоль осей такого тетраэдра, угол между любыми двумя осями – 109°. Четыре валентных электрона углерода располагаются на этих гибридных орбиталях:
Участие орбиталей в образовании простых химических связей.
Свойства электронов, разместившихся на четырех одинаковых орбиталях, эквивалентны, соответственно, будут эквивалентны химические связи, образованные с участием этих электронов при взаимодействии с атомами одного типа.
Взаимодействие атома углерода с четырьмя атомами водорода сопровождается взаимоперекрыванием вытянутых гибридных орбиталей углерода со сферическими орбиталями водородов. На каждой орбитали находится по одному электрону, в результате перекрывания каждая пара электронов начинает перемещаться по объединенной – молекулярной орбитали.
Гибридизация приводит лишь к изменению формы орбиталей внутри одного атома, а перекрывание орбиталей двух атомов (гибридных или обычных) приводит к образованию химической связи между ними. В данном случае (см. рисунок, помещенный ниже) максимальная электронная плотность располагается вдоль линии, связывающей два атома. Такую связь называют s-связью.
В традиционном написании структуры образовавшегося метана вместо перекрывающихся орбиталей используют символ валентной черты. Для объемного изображения структуры валентность, направленную от плоскости чертежа к зрителю показывают в виде сплошной клиновидной линии, а валентность, уходящую за плоскость рисунка – в виде штриховой клиновидной линии:
Таким образом, структура молекулы метана определяется геометрией гибридных орбиталей углерода:
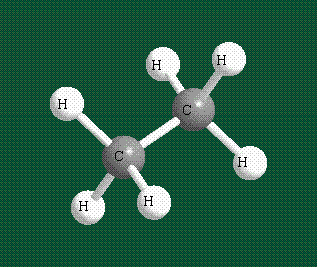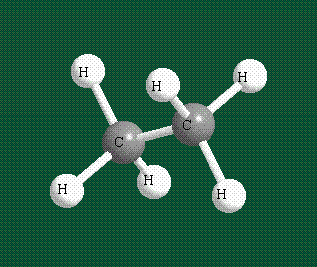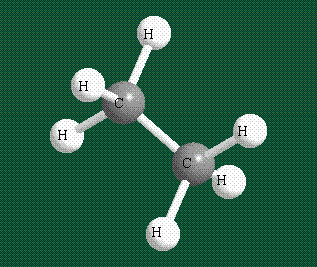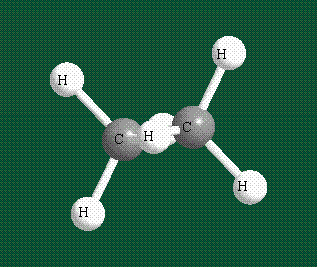
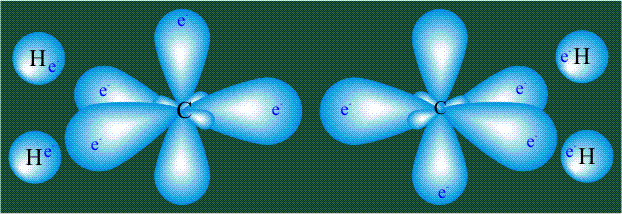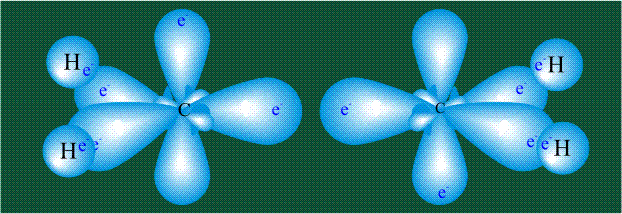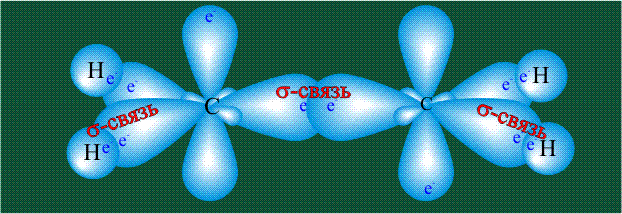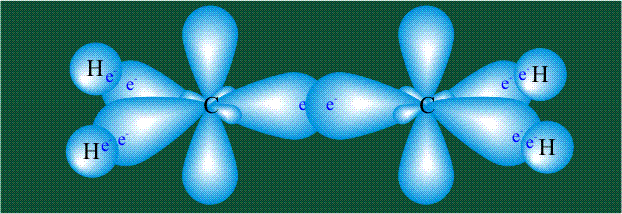
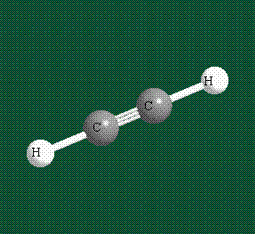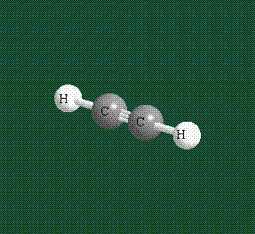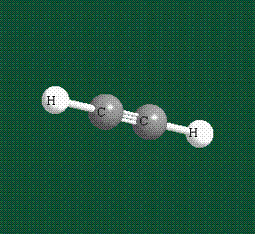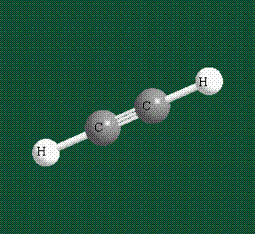
Образование молекулы этана аналогично показанному выше процессу, отличие состоит в том, что при взаимоперекрывании гибридных орбиталей двух атомов углерода происходит образование С-С – связи:
Геометрия молекулы этана напоминает метан, валентные углы 109°, что определяется пространственным расположением гибридных орбиталей углерода:
Участие орбиталей в образовании кратных химических связей.
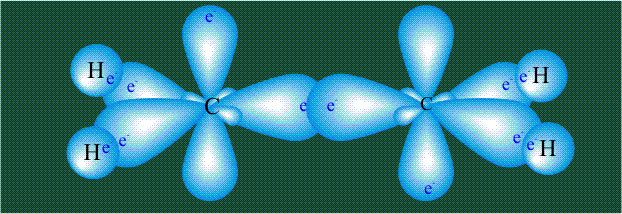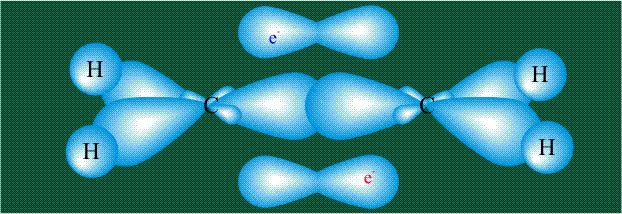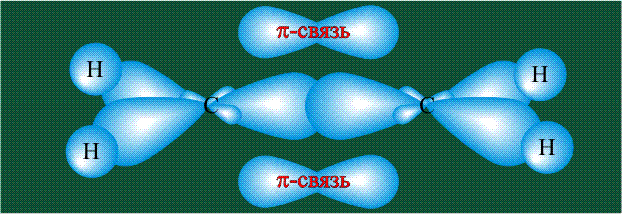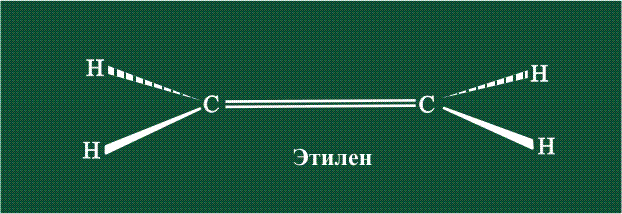
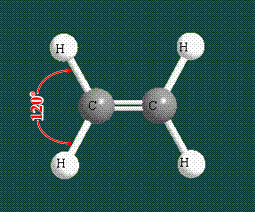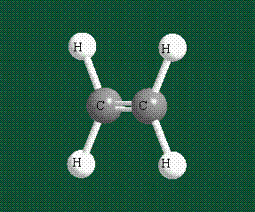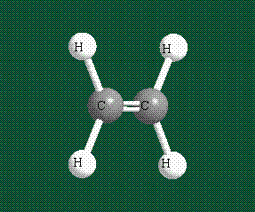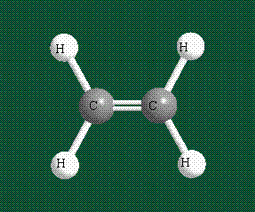
Молекула этилена образована также с участием орбиталей-гибридов, однако в гибридизации участвуют одна s-орбиталь и только две р-орбитали (рх и ру), третья орбиталь – pz, направленная вдоль оси z, в образовании гибридов не участвует. Из исходных трех орбиталей возникают три гибридных орбитали, которые располагаются в одной плоскости, образуя трехлучевую звезду, углы между осями – 120°:
Два атома углерода присоединяют четыре атома водорода, а также соединяются между собой, образуя s-связь С-С:
Две орбитали pz, не участвовавшие в гибридизации, взаимоперекрываются, их геометрия такова, что перекрывание происходит не по линии связи С-С, а выше и ниже ее. В результате образуются две области с повышенной электронной плотностью, где помещаются два электрона (отмечены синим и красным цветом), участвующие в образовании этой связи. Таким образом, образуется одна молекулярная орбиталь, состоящая из двух областей, разделенных в пространстве. Связь, у которой максимальная электронная плотность расположена вне линии, связывающей два атома, называют p-связью:
Вторая валентная черта в обозначении двойной связи, широко используемая для изображения ненасыщенных соединений уже не одно столетие, в современном понимании подразумевает наличие двух областей с повышенной электронной плотностью, расположенных по разные стороны линии связи С-С.
Структура молекулы этилена задана геометрией гибридных орбиталей, валентный угол Н-С-Н – 120°:
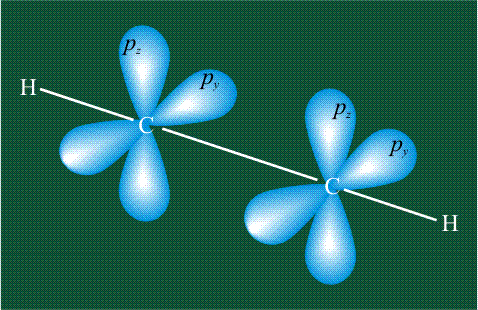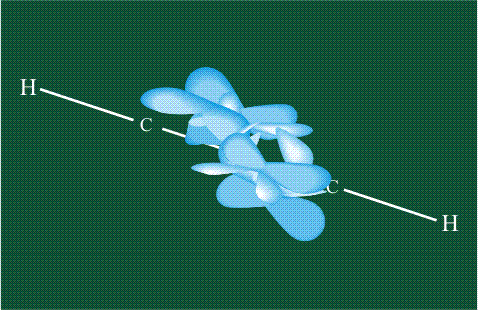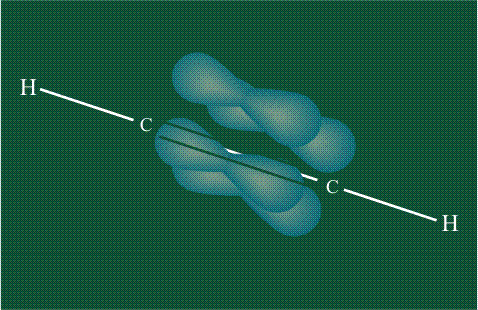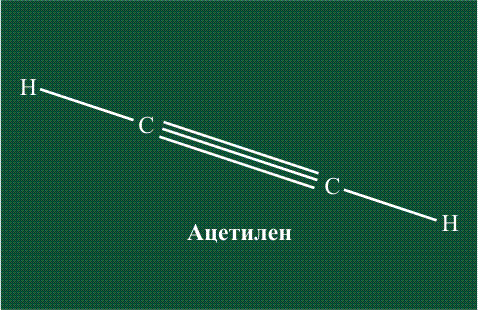
При образовании ацетилена в гибридизации участвует одна одна s-орбиталь и одна рx-орбиталь (орбитали pyи pz, в образовании гибридов не участвуют). Две образовавшиеся гибридные орбитали располагаются на одной линии, вдоль оси х:
Взаимоперекрывание орбиталей-гибридов друг с другом и с орбиталями атомов водорода приводит к образованию s-связей С-С и С-Н, изображаемых с помощью простой валентной черты:
Две пары оставшихся орбиталей pyи pz взаимоперекрываются. На рисунке, приведенном ниже, цветными стрелками показано, что из чисто пространственных соображений наиболее вероятно перекрывание орбиталей с одинаковыми индексами х-х и у-у. В результате образуются две p-связи, окружающие простую s-связь С-С:
В итоге молекула ацетилена имеет палочкообразную форму:
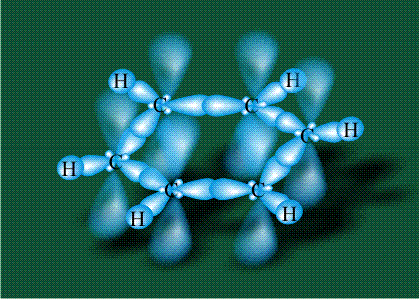
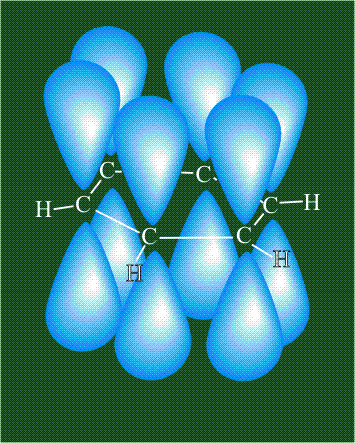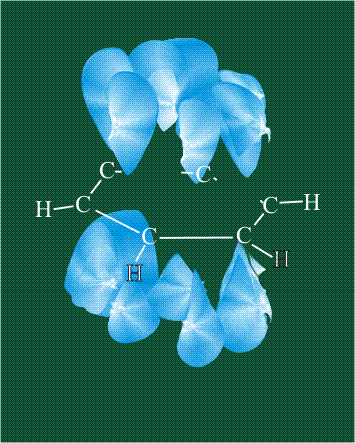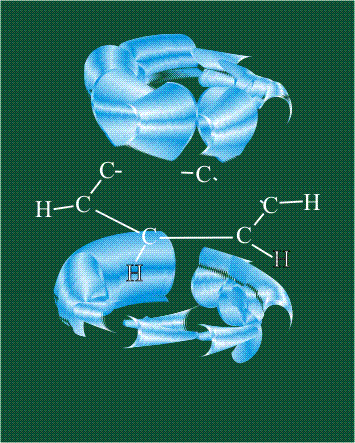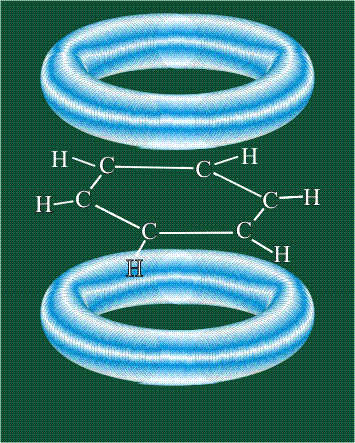
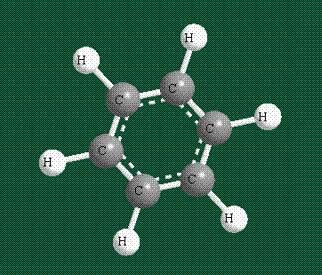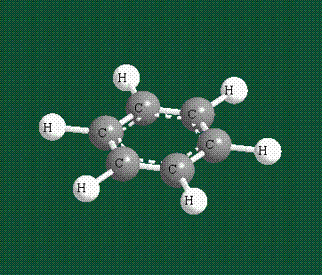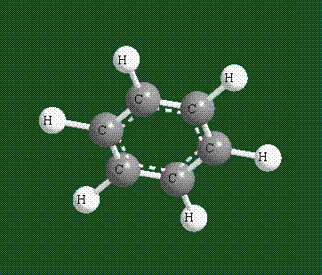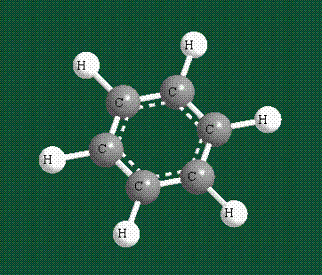
У бензола остов молекулы собран из атомов углерода, имеющих гибридные орбитали, составленные из одной s- и двух р-орбиталей, расположенные в форме трехлучевой звезды (как у этилена), р-орбитали, не участвующие в гибридизации, показаны полупрозрачными:
Шесть оставшихся р-орбиталей взаимоперекрываются, образуя молекулярную орбиталь в виде двух кольцевых областей, над и под плоскостью бензольного цикла:
Возникает единая замкнутая электронная система (см. также АРОМАТИЧНОСТЬ).
Молекула бензола плоская, что задано плоской конфигурацией «трехлучевых звезд», из которых она собрана. Молекулярную орбиталь, образованную перекрыванием шести атомных р-орбиталей обозначают в виде кольцевого символа внутри бензольного цикла:
В образовании химических связей могут также участвовать вакантные, то есть, не содержащие электронов орбитали (см. также ТРЕХЦЕНТРОВЫЕ СВЯЗИ).
Орбитали высоких уровней.
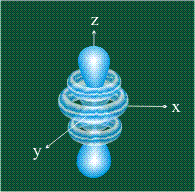
Начиная с четвертого электронного уровня, у атомов появляются пять d-орбиталей, их заполнение электронами происходит у переходных элементов, начиная со скандия. Четыре d-орбитали имеют форму объемных четырехлистников, называемых иногда «клеверным листом», они отличаются лишь ориентацией в пространстве, пятая d-орбиталь представляет собой объемную восьмерку, продетую в кольцо:
d-Орбитали могут образовывать гибриды с s- и p-орбиталями. Параметры d-орбиталей обычно используют при анализе строения и спектральных свойств в комплексах переходных металлов.
Начиная с шестого электронного уровня, у атомов появляются семь f-орбиталей, их заполнение электронами происходит в атомах лантаноидов и актиноидов. f-Орбитали имеют довольно сложную конфигурацию, ниже на рисунке показана форма трех из семи таких орбиталей, имеющих одинаковую форму и ориентированных в пространстве различным образом:
f-Орбитали весьма редко используют при обсуждении свойств различных соединений, поскольку расположенные на них электроны практически не принимают участия в химических превращениях..
Перспективы.
На восьмом электронном уровне находится девять g-орбиталей. Элементы, содержащие электроны на этих орбиталях, должны появится в восьмом периоде, пока они недоступны (в ближайшее время ожидается получение элемента № 118, последнего элемента седьмого периода Периодической системы, его синтез проводят в Объединенном институте ядерных исследований в Дубне).
Форма g-орбиталей, вычисленная методами квантовой химии, еще более сложная, чем у f-орбиталей, область наиболее вероятного местонахождения электрона в данном случае выглядит весьма причудливо. Ниже показан внешний вид одной из девяти таких орбиталей:
В современной химии представления об атомных и молекулярных орбиталях широко используют при описании строения и реакционных свойств соединений, также при анализе спектров различных молекул, в некоторых случаях – для прогнозирования возможности протекания реакций.
Михаил Левицкий
Минкин В.И., Симкин Б.Я., Миняев P.M. Теория строения молекул. Электронные оболочки. М., «Мир», 1979
Бучаченко А.Л. Химия как музыка, или химические ноты и новые мелодии нового века. Сборник научно-популярных статей, Москва, 2002
Российская наука: дорога жизни. Сборник научно-популярных статей. М., «Октопус», 2002
Ответь на вопросы викторины «Неизвестные подробности»