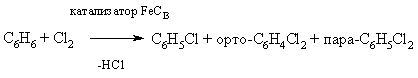ОРГАНИЧЕСКИЕ ГАЛОГЕНИДЫ
ОРГАНИЧЕСКИЕ ГАЛОГЕНИДЫ (органогалогениды, галогензамещенные углеводороды) – класс органических соединений, которые содержат атомы галогена Hal, соединенные с углеводородной группой. Этот класс соединений описывает формула R–Hal, где R – углеводородная группа, Hal = F, Cl, Br, I.
В зависимости от положения атома Hal в углеводородной цепи различают первичные, вторичные и третичные органогалогениды.
В первичных органогалогенидах атом галогена присоединен к первичному атому С (т.е. связанному, помимо галогена, только с одним углеродным атомом: СH3–CH2–Cl, СH3–CH2–CH2– Cl). Первичный атом С выделен жирным шрифтом.
Во вторичных органогалогенидах атом галогена присоединен к вторичному атому С (связанному, помимо галогена, с двумя углеродными атомами: СH3–CH2–CH(Cl)–СH3), вторичный атом С выделен жирным шрифтом.
В третичных органогалогенидах атом галогена присоединен к третичному атому С (жирный шрифт), связанному одновременно с тремя атомами углерода: (СH3)3С–Cl. Таким образом, атом галогена, в соответствии с типом атома С, к которому он присоединен, также называют первичным, вторичным или третичным.
В зависимости от типа органической группы, связанной с галогеном, различают алкилгалогениды R–Hal, (где R – насыщенная или ненасыщенная алифатическая группа) и арилгалогениды Ar–Hal (Ar – фенильная, нафтильная группа и т.п.).
Номенклатура органических галогеноидов.
Названия органогалогенидов составляют следующим образом: к названию углеводородной группы добавляют слово «хлорид» (фторид, бромид, йодид), например, СH3–CH2–Cl – этилхлорид, СH3–CH(Br)–СH3 – изопропилбромид. В более сложных случаях за основу берут название углеводорода, углеродную цепь нумеруют и затем используют нумерацию, чтобы указать положение галогена и других заместителей вдоль основной цепи. Все заместители перечисляют в алфавитном порядке (рис. 1). Названия, составленные по таким правилам, называют систематическими.
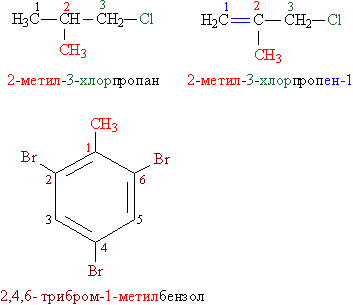
Рис. 1. СИСТЕМАТИЧЕСКИЕ НАЗВАНИЯ АЛКИЛ- И АРИЛГАЛОГЕНИДОВ. Замещающие группы и соответствующие им цифровые индексы выделены различающимися цветами.
Если все атомы Н в углеводороде замещены атомами галогена, то к названию соединения добавляют приставку «пер», например, Cl3C–CCl3 – перхлорэтан. Для некоторых галогенуглеводородов широко используют исторически сложившиеся тривиальные названия (см. ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ): HCCl3 –хлороформ (систематическое название трихлорметан), CH2=CH–Cl – винилхлорид (систематическое название хлорэтен).
Физические свойства органических галогеноидов.
Фторсодержащие алкилгалогениды, как правило, газообразные, хлор-, бром- и йодосодержащие – бесцветные подвижные жидкости (на свету йодосодержащие соединения приобретают коричневую окраску из-за частичного разложения). Температуры кипения алкилгалогенидов увеличиваются в направлении от фтора к йоду, и с ростом числа атомов галогена в соединении. Арилгалогениды – высококипящие жидкости. Органические галогениды неограниченно смешиваются с большинством органических растворителей и практически не смешиваются с водой.
Химические свойства органических галогеноидов.
Реакции органогалогенидов имеют некоторые общие закономерности: их реакционная способность возрастает в ряду RCl < RBr> RI, поэтому алкилйодиды (как наиболее химически активные) используются для различных лабораторных синтезов, а в промышленных процессах широко применяются алкилхлориды, т.к. хлор более распространен в природе и получение, а также использование хлорпроизводных экономически целесообразнее. Химическая активность галогена в RHal снижается при увеличении размера органической группы R, а также при переходе от первичных органогалогенидов к вторичным.
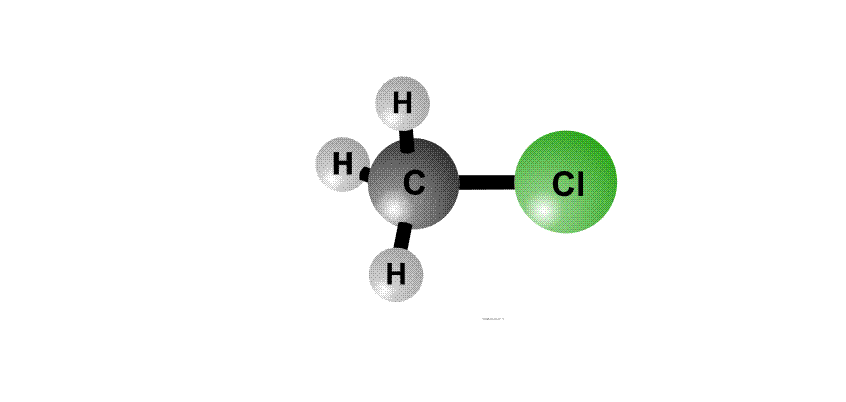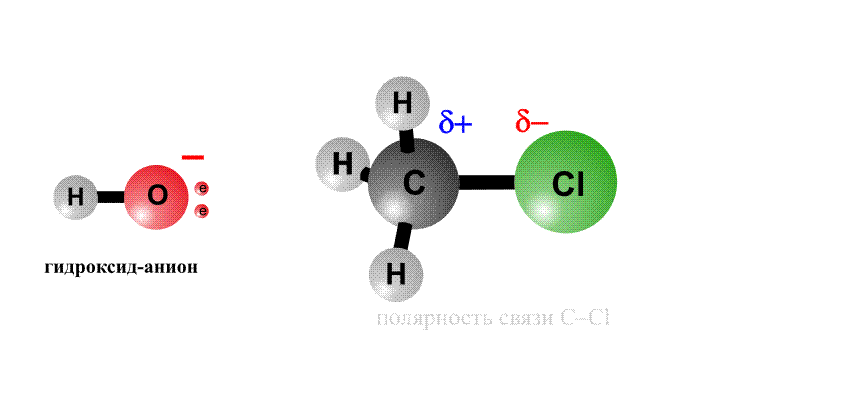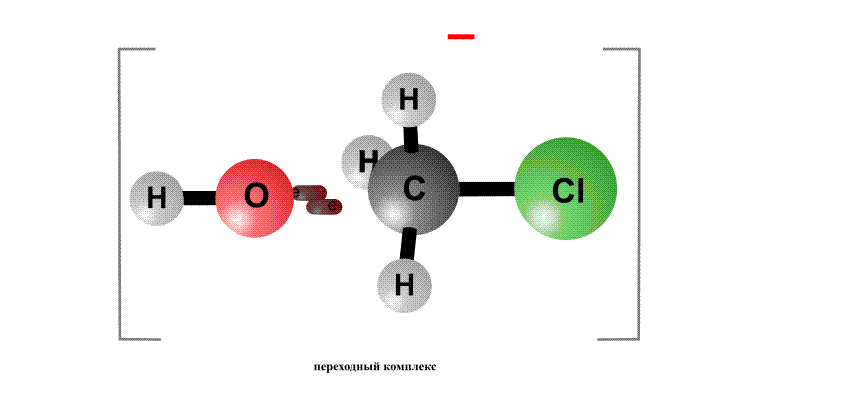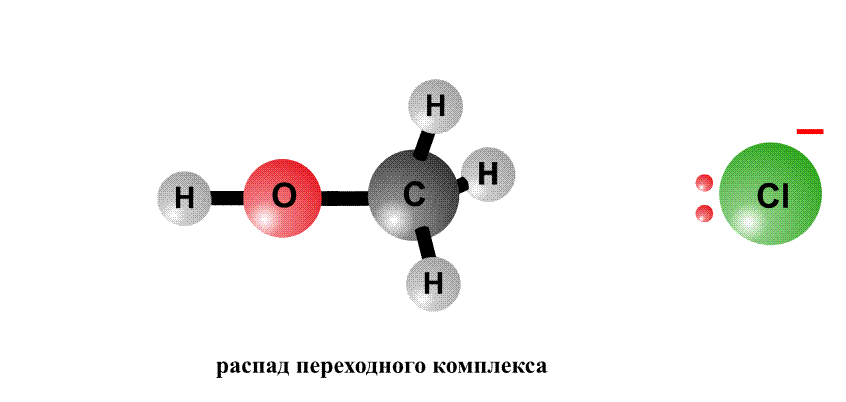
Реакционная способность органогалогенидов определяется тем, что в группировке С–Cl отрицательный заряд у хлора больше, чем у атома С, поэтому на атоме хлора возникает частичный отрицательный заряд d–, а на атоме С – положительный заряд d+, это называют поляризацией связи – возникают как бы полюса (рис. 2, первый фрагмент). Реагенты, несущие отрицательный заряд (анионы), движутся к положительному полюсу молекулы (к атому С, рис. 2, второй фрагмент). С помощью пары электронов, поставляемой анионом, образуется новая связь О–С. Возникает переходный комплекс (промежуточное соединение), в котором атом С имеет пять химических связей (рис. 2, третий фрагмент). Такой комплекс неустойчив и распадается, отщепляя анион Cl–, который уносит с собой пару электронов и отрицательный заряд.
Анион НО–, несущий отрицательный заряд, приближается к молекуле алкилхлорида с той стороны, где сосредоточен частичный положительный заряд. Образуется связь О–С. Возникший переходный комплекс с атомом С, содержащим пять химических связей, нестабилен и распадается, связь C–Cl разрывается, и анион Cl– уносит с собой пару электронов и отрицательный заряд.
Процессы, когда замещающая группа (ОН) приближается к реагенту не с той стороны, где расположена уходящая группа (Cl), часто встречаются в органической химии (см. ВАЛЬДЕНОВСКОЕ ОБРАЩЕНИЕ).
Схема (рис. 2) «не работает», когда атом галогена присоединен к атому С, участвующему в образовании двойной связи (винилхлорид CH2=CH–Cl), или непосредственно присоединен к ароматическому ядру (хлорбензол C6H5Cl). Кратная связь и ароматическая группа оттягивают на себя электроны, в результате поляризация связи C–Cl заметно снижается и соединение становится неактивным. Если «отодвинуть» атом Hal от двойной связи или ароматического ядра с помощью промежуточной группы CH2, то активность Hal резко возрастает, например, в аллилхлориде CH2=CH–CH2Cl или бензилхлориде C6H5CH2Cl. Через CH2-группу влияние кратной связи и ароматической группы не передается.
В соответствии со схемой (рис. 2) алкилгалогениды реагируют с разнообразными анионами, эти реакции показаны не в ионной форме, а в виде суммарного уравнения реакции. От алкилгалогенидов ведут пути практически ко всем крупным классам органических соединений. При взаимодействии с водными растворами разбавленных щелочей алкилгалогениды образуют спирты:
Н3C–Cl + NaOH = Н3C–OH + NaCl
Растворы концентрированных щелочей отщепляют от алкилгалогенида HCl, что приводит к образованию двойной связи:
Н3C–СН2–Cl + NaOH ® Н2C=СН2 + NaCl + Н2О
Реакция с алкоголятами щелочных металлов приводит к простым эфирам:
Н3C–Cl + NaOR ® Н3C–OR + NaCl
Из солей карбоновых кислот образуются сложные эфиры
Н3C–Cl + NaOC(O)R ® Н3C– OC(O)R + NaCl
Исходя из цианидов, получают нитрилы – соединения с фрагментом C–CєN:
Н3C–Cl + NaCєN ® Н3C–CєN + NaCl
Кислые сульфиды (соли сероводородной кислоты) приводят к образованию тиолов, называемых тиоспиртами, поскольку они представляют собой S-содержащие аналоги спиртов ne(S вместо О):
Н3C–Cl + KSH ® Н3C–SH + KCl
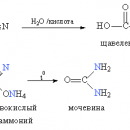
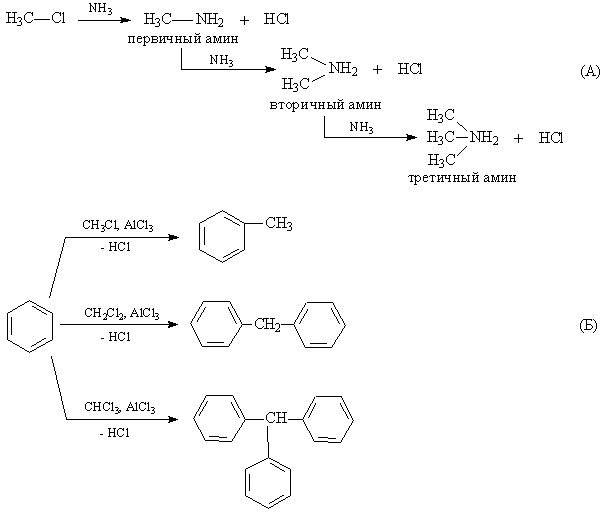
Взаимодействие с аммиаком сопровождается образованием первичных аминов, а в результате последовательных замещений – вторичных и третичных аминов (рис. 3А).
Алкилгалогениды используют и как алкилирующие агенты (в соединение вводится алкильная группа). В присутствии катализатора AlCl3 бензол алкилируется, если же в молекуле алкилхлорида есть два или более атома Hal, то он выступает в роли центра, объединяющего несколько бензольных колец (рис. 3Б).
Два атома Hal, расположенные у соседних углеродных атомов, открывают дополнительные возможности для синтеза. При действии металлического Zn на такие соединения в спиртовой среде образуются двойные или тройные связи (в зависимости от количества Hal в молекуле):
BrCH2–CH2Br + Zn ® CH2=CH2 + ZnBr2
Br2CH–CHBr2 + Zn ® CHєCH + ZnBr2
Если атомы Hal присоединены к удаленным атомам С, то цикл замыкается:
BrCH2–CH2– CH2–CH2Br + Zn ® CH2–CH2– CH2–CH2 + ZnBr2
В отличие от цинка металлический натрий может взаимодействовать и с соединениями, содержащими только один Hal, при этом он сдваивает органические группы (реакция Вюрца). Если в реакции участвуют различные алкилгалогениды, то сдваиваются как одинаковые, так и различные группы R:
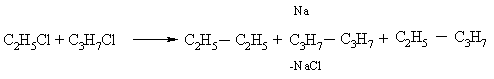
Получение органических галогенидов.
Прямое галогенирование углеводородов как алифатических, так и ароматических обычно приводит к смеси продуктов с различной степенью галогенирования:
C Н4 + Cl2 ® C Н3Cl + C Н2Cl2 + CНCl3
Йодировать таким способом углеводороды не удается, зато йод оказывается предпочтительным при другом способе получения галогенуглеводородов – присоединением HHal к двойной связи в олефинах, при этом наиболее легко присоединяется HI. Такой способ, называемый обычно гидрогалогенированием, в отличие от предыдущего, позволяет получать не смесь продуктов, а индивидуальные соединения. В соответствии с правилом Марковникова галоген присоединяется к тому атому С, который связан с меньшим числом атомов Н:
Н3C–СН=СН2 + HBr ® Н3C–СНBr–СН3
Присоединяться к двойной связи могут не только галогенуглеводороды, но и сами галогеналкилы, так получают перхлорированные (полностью хлорированные) углеводороды:
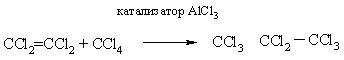
Тройная связь может присоединять галогенуглеводороды, в промышленности гидрохлорированием ацетилена синтезируют винилхлорид:
СНєСН + HCl ® СН2=СНCl
Широко используемый полимер поливинилхлорид (ПВХ) получают полимеризацией винилхлорида.
Взаимодействие спиртов галогеноводородами также приводит к галогеналкилам, это равновесный процесс (возможен как прямой, так и обратный процессы, обозначено сдвоенными стрелками), чтобы сдвинуть реакцию в нужном направлении, из реакционной среды удаляют образующуюся воду, связывая ее с помощью серной кислоты или ZnCl2:
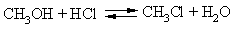
ОН-группу в спиртах можно заменить галогеном с помощью галогенидов фосфора, в зависимости от природы связанного с фосфором галогена получают соответственно хлор-, бром- или йодалкилы:
С2Н5ОН + PCl5® С2Н5Cl + PОCl3 + НCl
2С2Н5ОН + PI3® 2 С2Н5I + HPО2 + НCl
Применение органических галогеноидов.
Способность органогалогенидов растворять жиры и масла определила их применение в качестве средств для обезжиривания металлических поверхностей.
Тетрахлорэтилен ССl2 = ССl2 используют в установках для чистки одежды (химическая чистка).
Фторхлорзамещенные метаны и этаны CHC1F2, CF2C1–CF2C1 – негорючие вещества, газообразные при комнатной температуре, легко сжижаются под давлением, это позволяет использовать их для заполнения баллонов, в которые предварительно помещены различные бытовые препараты – косметические средства, лекарственные вещества, инсектициды и краски (аэрозольная упаковка).
Соединения сходного состава CF2C12 и CHF2C1 (торговые названия фреоны и хладоны) применяют в качестве хладагентов, это вещества, которые при кипении или в процессе расширения отнимают теплоту от охлаждаемого объекта и затем после сжатия передают ее охлаждающей среде – воде или воздуху. Хладагенты – «рабочие вещества» в холодильных установках.
Фторхлорзамещенные метаны и этаны используют также как вспенивающие агенты при производстве пенопластов.
Трифторбромметан CF3Br и тетрафтордибромэтан C2F4Br2 – легкокипящие негорючие жидкости с весьма высокой плотностью паров, их используют для заполнения огнетушителей особого типа, использование которых не требует присутствия человека. Баллон, содержащий такое вещество, с предварительно открытым вентилем быстро помещают в горящее помещение и плотно закрывают дверь. Пары галогенуглеводорода, постепенно заполняют все помещение, начиная от пола, вытесняют воздух и останавливают горение.
Винилхлорид СН2=СНCl – мономер, при полимеризации которого получают широко распространенный полимер поливинилхлорид (ПВХ), используемый для создания пленочных материалов, в качестве электроизоляции проводов и кабелей, в быту он известен как материал для изготовления линолеума и искусственной кожи.
Полимеризацией тетрафторэтилена CF2=CF2 получают политетрафторэтилен (фторопласт, тефлон), обладающий необыкновенным сочетанием эксплуатационных свойств: механической прочностью, высокими диэлектрическими параметрами, исключительной химической устойчивостью, низким коэффициентом трения, а также широкой областью рабочих температур (от –260 до +260° С). Из фторопласта изготавливают пленки, волокна, шланги, электроизоляцию для проводов и кабелей, химические реакторы, контейнеры для агрессивных жидкостей, трущиеся детали, не требующие смазки, и даже протезы органов человека.
Михаил Левицкий
Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. Издательство Московского университета. 1999
Карцова А.А. Покорение вещества. Органическая химия. Издательство: Химиздат, 1999
Ответь на вопросы викторины «Неизвестные подробности»