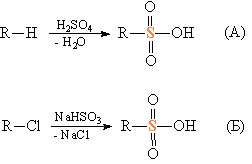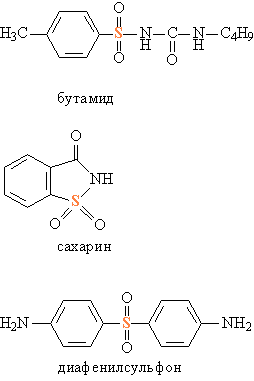СЕРАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
СЕРАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ – класс органических соединений (см. ХИМИЯ ОРГАНИЧЕСКАЯ), содержащих фрагмент C–S. К этому же классу причисляют и соединения, в которых атом S соединен с С не непосредственно, а через О или N. Многообразие этих соединений увеличивается, т.к. сера может проявлять в соединениях различную степень окисления: S(II), S(IV), S(VI).
Наиболее многочисленны соединения S(II), где сера выступает как аналог кислорода. Тиолы или тиоспирты R–S–H представляют собой серосодержащие аналоги спиртов. Тиоэфиры R–S–R соответствуют простым эфирам. Существуют и тиофенолы Ph–S–H, тиокарбонильные соединения: тиоальдегиды RC(=S)H, тиокетоны R2C=S), тиокарбоновые кислоты RC(=S)OH.
В сераорганических соединениях встречается фрагмент –S–S–, аналогичный пероксидному –О–О– в органических соединениях, например, диалкилдисульфиды R–S–S–R. Среди соединений с высокой степенью окисления серы распространены сульфоксиды R2S=O, а также сульфоновые кислоты R–SO2–OH, представляющие собой, по существу, серную кислоту с одним органическим заместителем, и сульфоны – серная кислота с двумя органическими заместителями R–SO2–R. Многие химические превращения с участием сераорганических соединений сопровождается изменением степени окисления серы.
Номенклатура сераорганических соединений.
В названии тиолов R–S–H за основу берут название соответствующего углеводорода (но не радикала) и добавляют суффикс «тиол», например, С4Н9SН – бутантиол (но не бутилтиол).
В отличие от тиолов, в названиях тиоэфиров R–S–R упоминают не углеводороды, а соответствующие радикалы, связанные с S, добавляя суффикс «сульфид», например, С4Н9SС2Н5 – бутилэтилсульфид. Часто используют обобщенное название тиоэфиров – органические сульфиды. Допускается и составление названий тиоэфиров по правилам, применяемым в случае углеводородов – углеводородную цепь нумеруют с того конца, который ближе к атому S, при этом атом S также нумеруется, а его положение указывают с помощью числового индекса: С4Н9SС2Н5 – 3-тиагептан (корень «гептан» означает 7 атомов в цепи, включая S). Если атом S входит в состав углеводородного цикла, то используют правила номенклатуры гетероциклических соединений. Названия сульфоксидов R2S=O составляют из названий двух органических групп, связанных с атомом S, добавляя слово «сульфоксид», например, CH3(C2H5)S=O метилэтилсульфоксид.
Словосочетание сульфоновые кислоты (R–SO2–OH) входит в название соединения, при этом дополнительно указывают название углеводорода (но не радикала), связанного с S, например, СН3–SO2–OH – метансульфоновая кислота (но не метилсульфоновая), СН3С6Н4–SO2–OH – толуолсульфоновая кислота. Часто сульфоновые кислоты именуют сокращенно сульфокислотами, поэтому последнее указанное соединение обычно называют толуолсульфокислотой.
Название сульфонов R–SO2–R (диорганозамещенная серная кислота) составляют из названия органических радикалов, связанных с S, добавляя слово «сульфон».
СН3–SO2–C2H5 – метилэтилсульфон.
Правила составления названий, несмотря на их кажущуюся сложность, весьма прозрачны: в тех случаях, когда c атомом S связана одна органическая группа (тиолы и сульфоновые кислоты), в названии упоминают углеводород – алкан, если же c атомом S связаны две группы (тиоэфиры, сульфоксиды, сульфоны), то название строят, исходя из радикала – алкила.
Химические свойства сераорганических соединений,
в основном, тех, что содержат S(II), напоминают свойства кислородсодержащих органических соединений.
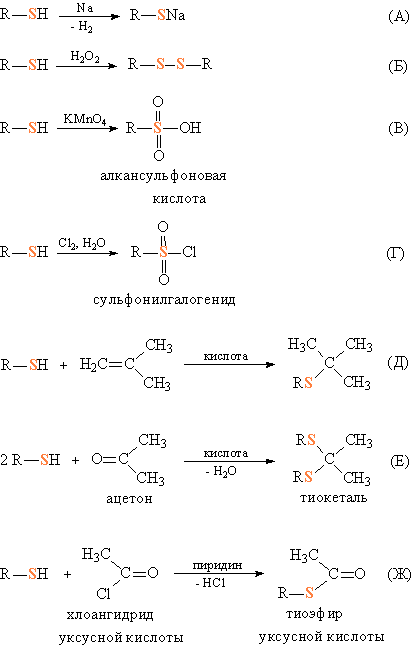
Тиолы – слабые кислоты и, подобно спиртам, могут реагировать с активными металлами, образуя тиоляты (рис. 1А). При действии мягких окислителей, например, пероксида водорода, они образуют дисульфиды (аналоги пероксидов) (рис. 1Б). Более сильные окислители (перманганаты) переводят их в алкилсульфоновые кислоты, в которых степень окисления серы VI (рис. 1В). В присутствии каталитических количеств кислоты тиолы присоединяются к олефинам по двойной связи (рис. 1Г). При взаимодействии тиолов с альдегидами или кетонами (катализатор – кислота) образуются тиоацетали или тиокетали (рис. 1Д) – аналоги соответствующих кислородных соединений. Подобно спиртам, тиолы реагируют с хлорангидридами карбоновых кислот (в присутствии оснований, связывающих образующийся HCl), образуя тиоэфиры карбоновых кислот (рис.1Ж) – близкие к органическим сложным эфирам.
Рис.1. РЕАКЦИИ С УЧАСТИЕМ ТИОЛОВ.
Метантиол при обычных условиях – газообразный, остальные, вплоть до додекантиола, – жидкости. Алифатические тиолы токсичны и обладают резким неприятным запахом, который можно почувствовать при очень низких концентрациях, менее 10–8 мг/л, поэтому их (метантиол или бутантиол) добавляют в очень незначительных количествах к бытовому газу, не имеющему запаха, что позволяет вовремя заметить утечку газа. Скунс, животное семейства куньих, распространенное от Южной Канады до Центральной Америки, выделяет вещество с неприятным отпугивающим запахом тиолов, разбрызгивая в сторону нападающего бутантиол CH3CH2CH2CH2SH, вырабатываемый специальными железами.
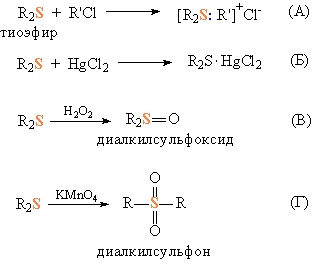
Тиоэфиры подобно своим аналогам простым эфирам, могут образовывать донорно-акцепторные связи за счет неподеленных пар электронов у атома S, при этом получаются комплексные соединения, например, в результате присоединения к тиоэфирам алкилхлоидов (рис. 2А) или солей тяжелых металлов (рис. 2Б). При действии слабых окислителей (пероксид водорода) тиоэфиры окисляются до сульфоксидов (соединений, содержащих группировку >S=O, рис. 2В), взаимодействие с более сильными окислителями (KMnO4, HNO3) переводит их в сульфоны, представляющие собой серную кислоту с двумя органическим заместителями (рис. 2Г).
Рис. 2. ХИМИЧЕСКИЕ СВОЙСТВА ТИОЭФИРОВ
В отличие от тиолов, хорошо очищенные тиоэфиры не обладают запахом и не токсичны, но некоторые их галогенпроизводные ядовиты, например, отравляющее вещество иприт (ClCH2CH2)2S.
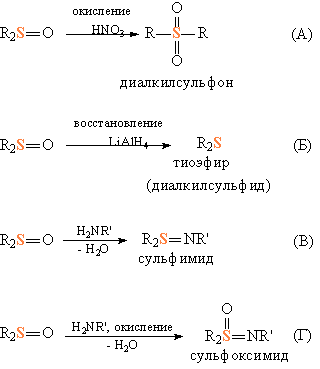
Сульфоксиды R2S=O – промежуточные структуры между тиоэфирами и сульфонами: при окислении сульфоксидов образуются сульфоны (рис. 3А), а при их восстановлении – тиоэфиры (рис. 3Б). В то же время по свойствам они немного похожи на органические карбонильные соединения: при взаимодействии с аминами образуют сульфимиды (рис. 3В) – соединения, напоминающие имиды (точнее, основания Шиффа), у которых отличительный признак – фрагмент >C=NR. Сравнивая с органическими аналогами, можно видеть, что атом S как бы заменяет собой атом С. Несмотря на то, что сульфоксиды R2S=O можно формально рассматривать как аналоги кетонов R2С=O, их химическое поведение все же заметно отличается, прежде всего, из-за способности S легко менять степень окисления. Например, если то же присоединение аминов, что и на рис. 3В, проводить с одновременным окислением, получаются сульфоксимиды (рис. 3Г) – сера переходит в состояние S(VI).
Рис. 3. ХИМИЧЕСКИЕ СВОЙСТВА СУЛЬФОКСИДОВ
Сульфоновые кислоты представляют собой сильные кислоты, сравнимые с серной, они реагируют с неорганическими основаниями, образуя водорастворимые соли сульфоновых кислот – сульфонаты (рис. 4А). При действии хлорирующих реагентов (PCl5) образуются сульфохлориды, напоминающие хлорангидриды карбоновых кислот (рис. 4Б), а восстановление сульфоновых кислот приводит к тиолам (рис. 4В). Когда сульфогруппа присоединена к бензольному ядру, она подвижна и может быть заменена другими функциональными группами: при действии амида натрия образуется анилин (рис. 4Г), сплавление со щелочью приводит к фенолу (рис. 4Д), а взаимодействие с HNO3 – к нитробензолу (рис. 4Е). При взаимодействии сульфокислот с простыми эфирами (рис. Ж) образуются эфиры сульфоновых кислот RS(O)2–OR. Они представляют собой аналоги сложных эфиров. Намного легче такие же соединения получаются при взаимодействии сульфохлорида со спиртами (рис. З) – типичный способ получения сложных эфиров.
Рис.4. РЕАКЦИИ С УЧАСТИЕМ СУЛЬФОНОВЫХ КИСЛОТ.
Получение сераорганических соединений.
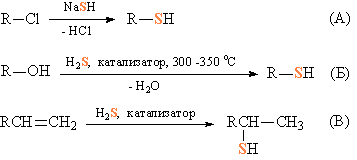
Тиолы получают взаимодействием кислых неорганических сульфидов с галогеналкилами (рис. 5А), взаимодействием в газовой фазе спиртов с H2S при 300–350° в присутствии катализаторов Al2O3 или ThO2 (рис. 5Б), или каталитическим присоединением H2S к двойной связи олефинов, катализаторы – сульфидов металлов (рис. 5В).
Рис. 5. ПОЛУЧЕНИЕ ТИОЛОВ
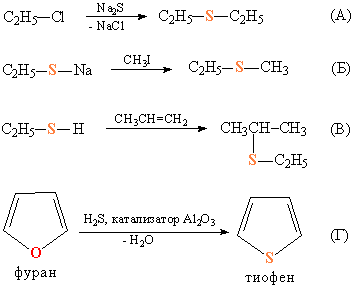
Тиоэфиры получают взаимодействием галогеналкилов с неорганическими сульфидами (рис. 6А). Когда нужно получить тиоэфиры с различающимися органическими группами, проводят взаимодействие галогеналкилов с тиолятами щелочных металлов (рис. 6Б), либо присоединением тиолов к олефинам (рис. 6В). О В некоторых простых эфирах, имеющих циклическое строение, можно заменить атом О атомом S, при этом образуется циклический тиоэфир, например, тиофен, который относят к гетероциклическим соединениям (рис. 6Г).
Рис 6. СПОСОБЫ ПОЛУЧЕНИЯ ТИОЭФИРОВ
Наиболее распространенный способ получения сульфоксидов – окисление тиоэфиров (рис. 2В).
Сульфоновые кислоты получают окислением тиолов (рис. 1В) и взаимодействием углеводородов с серной кислотой (рис. 7А) или неорганических сульфитов с алкилгалогенидами (рис. 7Б).
Рис. 7. ПОЛУЧЕНИЕ СУЛЬФОНОВЫХ КИСЛОТ
Два способа получения сульфонов – окислением тиоэфиров и окислением сульфоксидов – были показаны ранее (рис. 2Г и 3А). Кроме того, сульфоны получают присоединением сульфохлоридов к двойной связи олефина, при этом одна из органических групп в получившемся сульфоне содержит галоген (рис. 8А). При взаимодействии сульфохлорида с бензолом образуется фенилсодержащий сульфон (рис. 8Б).
Рис. 8. ПОЛУЧЕНИЕ СУЛЬФОНОВ
Сераорганические соединения в нефти. Наряду с углеводородами, нефть включает заметное количество серосодержащих соединений. В некоторых сортах нефти содержание серы достигает 6–8%, то тиолы и тиоэфиры, среди которых заметное место занимает циклический тиоэфир тиофен (рис. 6). В процессе переработки нефти эти соединения попадают в моторное топливо и моторные масла. При сжигании в двигателях полученного из нефти моторного топлива образуется диоксид серы, загрязняющий атмосферу и выпадающий в виде кислотных дождей, губительно действующих на живые организмы и приводящих к коррозии технических сооружений. Моторные масла, содержащие сераорганические соединения, также вызывают ускоренную коррозию оборудования, поэтому в процесс переработки нефти включают стадию, позволяющую снизить (до нескольких долей процента) содержание neS-органических соединений в нефтепродуктах. При обработке водородом под давлением при температуре 380–420° C и в присутствии катализаторов (оксиды и сульфиды Со, Мо, W) S-органические соединения распадаются с образованием углеводородов и сероводорода Н2S (процесс гидроочистки, иногда используют более информативный термин – гидрообессеривание). Затем Н2S превращают в элементную серу или серную кислоту. Разработаны способы удаления соединений серы, содержащихся в нефти, с превращением их в технически важные сераорганические соединения, например, сульфоксиды, при этом проводят окисление по схеме, аналогичной той, что на рис. 2В).
Сераорганические соединения биологического происхождения.
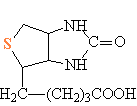
Аминокислота метионин CH3SCH2CH2CH(NH2)COOH (тиоэфир) R-S-R) играет важную роль во многих биологических процессах. Она относится к группе незаменимых аминокислот, которые организм млекопитающих должен получать с продуктами питания (см. БЕЛКИ), суточная потребность этой аминокислоты для человека 2,5–3 г, в природе ее синтезируют некоторые микроорганизмы и растения, далее метионин с продуктами питания попадает в организм млекопитающих. Метионин входит в состав многих белковых молекул и участвует в биохимических процессах, приводящих к синтезу адреналина. Недостаток метионина в пище животных и человека приводит к нарушению биосинтеза белков, замедлению роста и развития организма. Кроме того, метионин – главный источник, поставляющий в организм атомы S, необходимые для биосинтеза другой аминокислоты – цистеина HSCH2CH(NH2)COOH (тиол, содержит фрагмент –SH). Цистеин составляет основную часть белковых молекул, из которых образуются кожные и волосяные покровы млекопитающих. Помимо этого, на основе цистеина кишечная флора млекопитающих синтезирует ферменты (биологические катализаторы), участвующие в переработке углеводов и жиров. Биологически важное соединение биотин (витамин Н, бициклический тиоэфир, рис. 9), участвующий в процессах переноса углекислоты, при его недостатке развивается кожное заболевание себорея.
Рис. 9. БИОТИН (витамин Н)
Летучие компоненты, определяющие запах чеснока, содержат соединение класса сульфоксидов – алиин CH2=CHCH2S(O)CH2CH(NH2)COOH (производное цистеина), а также тиоэфир диаллилсульфид (CH2=CHCH2)2S и ряд других S-содержащих соединений, В целом, запах чеснока определяется сочетанием почти десяти соединений этого класса. Чесночный запах изо рта определяется веществами, которых в чесноке нет. Установлено, что под действием биологических катализаторов (ферментов) эти соединения частично превращаются в организме в диаллилдисульфид CH2=CHCH2S–SCHCH2=CH2 и сульфоксид-сульфид – аллицин CH2=CHCH2S(О)–SCHCH2=CH2, которые из пищеварительного тракта всасываются в кровь, попадают в легкие и затем выдыхаются. Установлено, например, что S-содержащие компоненты чеснока снижают уровень холестерина в крови, тормозят протекание онкологических процессов, защищают печень от токсинов.
Запах лука обусловлен, в основном, присутствием аллилпропилдисульфида CH2=CHCH2S–SCH2CH2CH3.
Применение сераорганических соединений.
При автоокислении многих органических соединений возникают свободные радикалы (соединения, содержащие неспаренный электрон у атома углерода), которые далее ведут цепной процесс окисления. Тиолы и тиоэфиры используют как эффективные ловушки свободных радикалов, при этом они окисляются подобно тому, как показано на рис. 1Б и 2В. Это свойство позволяет использовать ихв качестве стабилизаторов, защищающих моторные топлива и масла от окисления. Для стабилизации каучуков используют трудно испаряющиеся соединения, например, додекантиол С12Н23SH.
Свойство тиолов «гасить» свободные радикалы нашло применение в создании радиопротекторов – веществ, защищающих от радиоактивного излучения. Для этих целей используют различные аминотиолы и их производные, например, H2N(CH2)nSH.
Радиопротекторы вводят в организм до облучения перед радиотерапевтическим лечением в медицине при долговременных космических полетах для защиты от солнечных вспышек. В результате заметно снижается доза полученной радиации.
На основе сераорганических соединений, содержащих дисульфидные группировки –S–S–, созданы полимеры – полисульфидные каучуки (промышленное название – тиоколы), которые получают поликонденсацией дигалогенпроизводных алифатических соединений Cl–R–Cl [R = (CH2)2, (CH2)3] и дисульфида натрия Na2S2, в результате образуются полисульфиды [–R–S–S–]n. Такие каучуки при добавлении окислителей (например, бихроматов) образуют сшитые резиноподобные материалы – вулканизаты, которые по прочности уступают обычным каучукам, но превосходят их по бензо- и маслостойкости, а также по атмосферостойкости, они не теряют механических свойств при действии влаги, смене температур и воздействии солнечной радиации. Это позволяет применять их при изготовлении бензо- и маслопроводов как внутренние покрытия резервуаров для хранения топлива, для герметизации швов между бетонными панелями при строительстве домов и как надежную шпатлевку для лодок и яхт.
Среди сульфоксидов наиболее распространен получил диметилсульфоксид (CH3)2S=O – соединение с высокими растворяющими способностями, кроме того, он легко образует растворимые комплексы с неорганическими соединениями большинства металлов. Его широко применяют для экстракции металлов, органических кислот и фенолов, кроме того, в производстве синтетических волокон и в качестве пластификаторов полимерных материалов.
Из щелочных солей сульфоновых кислот – сульфонатов (рис. 4А) изготавливают все современные порошкообразные и жидкие синтетические моющие средства. Они легко растворяются в воде и обладают высокой пенообразующей способностью. Наиболее эффективны для этих целей соединения, в которых атом S соединен с крупной алифатической (С14–18) или арилалифатической (R–C6H4–) группой.
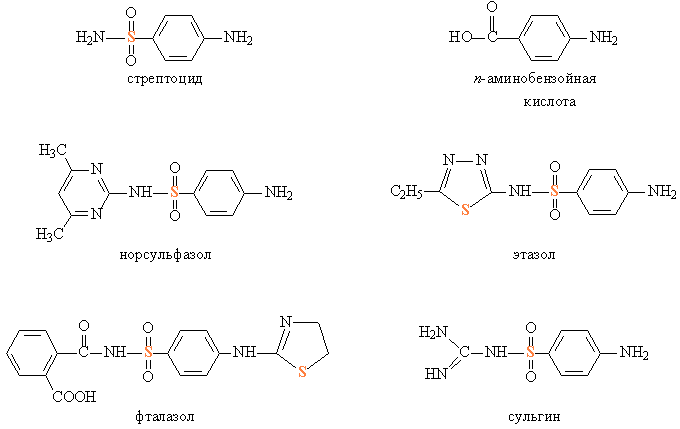
Сераорганические соединения входят в состав многих современных лекарственных средств, среди них самую большую группу образуют сульфаниламидные препараты – производные сульфоновой кислоты. Их высокая антимикробная активность была обнаружена случайно. В 1934 немецкий химик Г.Домагк обратил внимание на новый тип азокрасителей для шерстяных тканей и решил испытать биологическое действие одного из таких красителей (торговое название – красный пронтозил), который прочно связывался с шерстяными тканями. Он предположил, что краситель соединится с молекулами, образующими стенки бактерий, и тем самым затруднит их рост. Выяснилось, что азокраситель оказывает антимикробное действие, последующие исследования показали, что активен не сам краситель, а лишь фрагмент его молекулы – сульфаниламид, позже получивший название стрептоцид (рис. 10). Название «сульфаниламид» достаточно точно передает строение: сульфогруппа, соединенная с остатком анилина –С6Н4NH2, а также амидная группа, присоединенная к атому S.
Механизм действия стрептоцида и сходных с ним препаратов своеобразен. Стрептоцид близок по строению к п-аминобензойной кислоте (рис. 10), необходимой для роста микроорганизмов, без этой кислоты бактерии не могут размножаться. Стрептоцид как бы обманывает бактерии, он начинает конкурировать с п-аминобензойной кислотой, участвуя в биохимических процессах и приводя к образованию нежизнеспособных бактерий. Чтобы такая конкуренция была успешной, в организме больного человека нужно поддерживать в течение определенного времени повышенную концентрацию лекарства.
Сейчас разработано около 40 типов сульфаниламидных препаратов с широким спектром лечебного действия, они отличаются от стрептоцида наличием различных замещающих, как правило, гетероциклических групп у атомов азота, основной сульфаниламидный фрагмент сохраняется во всех препаратах неизменным. Сульфадимезин и этазол (рис. 10) активны против стрептококков, пневмококков, стафилококков и некоторых других бактерий. Эти препараты хорошо всасывается из желудочно-кишечного тракта и быстро накапливается в крови в необходимых концентрациях.
Для лечения желудочно-кишечных заболеваний (например, дизентерия) разработаны препараты фталазол, сульгин (рис. 10). Для всех лекарственных препаратов обычно используют их торговые наименования, а названия, составленные по правилам номенклатуры, применяют редко.
Известны и S-содержащие лекарственные препараты, которые не относятся к группе сульфаниламидов, например, производное сульфанилмочевины – бутамид (рис. 11) стимулирует работу поджелудочной железы, и потому его применяют при лечении диабета. Иную помощь оказывает больным диабетом имид сульфобензойной кислоты – сахарин (рис. 11), его используют как заменитель сахара, противопоказанного при диабете. Сахарин в 400 раз слаще сахара, он не усваивается организмом и выводится с мочой. Производное группы сульфонов 4,4'-диаминодифенилсульфон (торговое название – диафенилсульфон, рис. 11) – средство для лечения проказы.
Рис.11. НЕКОТОРЫЕ СЕРАОРГАНИЧЕСКИЕ ПРЕПАРАТЫ, не относящиеся к группе сульфаниламидов
Полиариленсульфоны – полимеры, в цепи которых чередуются фениленовые –С6Н4– (либо дифениленовые –С6Н4–С6Н4–) фрагменты и сульфогруппы SO2. Эти полимеры устойчивы до 400° С, обладают высокой механической прочностью, хорошими диэлектрическими свойствами и химической инертностью. Их используют для изготовления электротехнических изделий (корпуса индукционных катушек, переключателей), как конструкционные материалы (некоторые детали станков и автомобилей), а также в виде пленки для упаковки пищевых продуктов.
Михаил Левицкий
Химия органических соединений серы, под ред. Л. И. Беленького, М., Мир, 1988
Кукушкин Ю.Н. Химия вокруг нас. М., Высшая школа, 1992
Серов М. Честная сера и нечистая сила. Химия и жизнь – XXI век, № 2, 2001
Ответь на вопросы викторины «Неизвестные подробности»