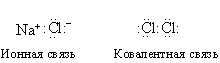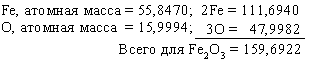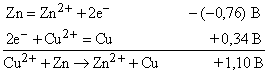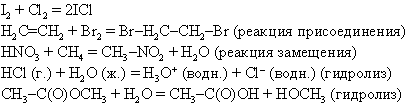ХИМИЯ
ХИМИЯ, наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций. Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей в организме; почему раствор соли проводит электрический ток, а раствор сахара – нет; почему одни химические изменения происходят быстро, а другие – медленно. Главная задача химии – выяснение природы вещества, главный подход к решению этой задачи – разложение вещества на более простые компоненты и синтез новых веществ. Используя этот подход, химики научились воспроизводить множество природных химических субстанций и создавать материалы, не существующие в природе. На химических предприятиях уголь, нефть, руды, вода, кислород воздуха превращаются в моющие средства и красители, пластики и полимеры, лекарства и металлические сплавы, удобрения, гербициды и инсектициды и т.д. Живой организм тоже можно рассматривать как сложнейший химический завод, на котором тысячи веществ вступают в точно отрегулированные химические реакции.
ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ
Элементы
Исследование сложного вещества начинается с попыток разложить его на более простые. Простейшая форма материи, в которой сохраняется определенная совокупность физических и химических свойств, называется химическим элементом. Химические элементы – это частицы вещества, представляющие собой совокупность атомов с одинаковым зарядом ядра. Водород, кислород, хлор, натрий, железо – все это элементы. Элемент нельзя разложить на более простые составляющие обычными методами: с помощью тепла, света, электричества или под действием другого вещества. Для этого нужны колоссальное количество энергии, специальное оборудование (например, ускоритель частиц) или высокие температуры, сравнимые с температурами в недрах Солнца. Из 109 известных элементов в природе существует девяносто два элемента, остальные получены искусственно. Все они систематизированы в периодической таблице элементов, где каждому элементу соответствует свой порядковый номер, называемый атомным номером (см. ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ; ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ). В табл. 1 перечислены первые 103 элемента в алфавитном порядке. Из этого ограниченного набора элементов и состоят миллионы химических веществ.
| Элемент | Символ | Атомный номер | Атомная масса |
| Азот | N | 7 | 14,0067 |
| Актиний | Ac | 89 | (227) |
| Алюминий | Al | 13 | 26,98154 |
| Америций | Am | 95 | (243) |
| Аргон | Ar | 18 | 39,948 |
| Астат | At | 85 | (210) |
| Барий | Ba | 56 | 137,33 |
| Бериллий | Be | 4 | 9,01218 |
| Берклий | Bk | 97 | (247) |
| Бор | B | 5 | 10,811 |
| Бром | Br | 35 | 79,904 |
| Ванадий | V | 23 | 50,9415 |
| Висмут | Bi | 83 | 208,9804 |
| Водород | H | 1 | 1,0079 |
| Вольфрам | W | 74 | 183,85 |
| Гадолиний | Gd | 64 | 157,25 |
| Галлий | Ga | 31 | 69,723 |
| Гафний | Hf | 72 | 178,49 |
| Гелий | He | 2 | 4,0026 |
| Германий | Ge | 32 | 72,59 |
| Гольмий | Ho | 67 | 164,9304 |
| Диспрозий | Dy | 66 | 162,50 |
| Европий | Eu | 63 | 151,96 |
| Железо | Fe | 26 | 55,847 |
| Золото | Au | 79 | 196,9665 |
| Индий | In | 49 | 114,82 |
| Иод | I | 53 | 126,9045 |
| Иридий | Ir | 77 | 192,22 |
| Иттербий | Yb | 70 | 173,04 |
| Иттрий | Y | 39 | 88,9059 |
| Кадмий | Cd | 48 | 112,41 |
| Калий | K | 19 | 39,0983 |
| Калифорний | Сf | 98 | (251) |
| Кальций | Ca | 20 | 40,078 |
| Кислород | O | 8 | 15,9994 |
| Кобальт | Co | 27 | 58,9332 |
| Кремний | Si | 14 | 28,0855 |
| Криптон | Kr | 36 | 83,80 |
| Ксенон | Xe | 54 | 131,29 |
| Кюрий | Cm | 96 | (247) |
| Лантан | La | 57 | 138,9055 |
| Лоуренсий | Lr | 103 | (260) |
| Литий | Li | 3 | 6,941 |
| Лютеций | Lu | 71 | 174,967 |
| Магний | Mg | 12 | 24,305 |
| Марганец | Mn | 25 | 54,9380 |
| Медь | Cu | 29 | 63,546 |
| Менделевий | Md | 101 | (258) |
| Молибден | Mo | 42 | 95,94 |
| Мышьяк | As | 33 | 74,9216 |
| Натрий | Na | 11 | 22,98977 |
| Неодим | Nd | 60 | 144,24 |
| Неон | Ne | 10 | 20,179 |
| Нептуний | Np | 93 | 237,0482 |
| Никель | Ni | 28 | 58,69 |
| Ниобий | Nb | 41 | 92,9064 |
| Нобелий | No | 102 | (259) |
| Олово | Sn | 50 | 118,710 |
| Осмий | Os | 76 | 190,2 |
| Палладий | Pd | 46 | 106,42 |
| Платина | Pt | 78 | 195,08 |
| Плутоний | Pu | 94 | (244) |
| Полоний | Po | 84 | (209) |
| Празеодим | Pr | 59 | 140,9077 |
| Прометий | Pm | 61 | (145) |
| Протактиний | Pa | 91 | 231,0359 |
| Радий | Ra | 88 | 226,0254 |
| Радон | Rn | 86 | (222) |
| Рений | Re | 75 | 186,207 |
| Родий | Rh | 45 | 102,9055 |
| Ртуть | Hg | 80 | 200,59 |
| Рубидий | Rb | 37 | 85,4678 |
| Рутений | Ru | 44 | 101,07 |
| Самарий | Sm | 62 | 150,36 |
| Свинец | Pb | 82 | 207,2 |
| Селен | Se | 34 | 78,96 |
| Сера | S | 16 | 32,066 |
| Серебро2) | Ag | 47 | 107,8682 |
| Скандий | Sc | 21 | 44,9559 |
| Стронций | Sr | 38 | 87,62 |
| Сурьма | Sb | 51 | 121,75 |
| Таллий | Tl | 81 | 204,383 |
| Тантал | Ta | 73 | 180,9479 |
| Теллур | Te | 52 | 127,60 |
| Тербий | Tb | 65 | 158,9254 |
| Технеций | Tc | 43 | [97] |
| Титан | Ti | 22 | 47,88 |
| Торий | Th | 90 | 232,0381 |
| Тулий | Tm | 69 | 168,9342 |
| Углерод | C | 6 | 12,011 |
| Уран | U | 92 | 238,0289 |
| Фермий | Fm | 100 | (257) |
| Фосфор | P | 15 | 30,97376 |
| Франций | Fr | 87 | (223) |
| Фтор | F | 9 | 18,998403 |
| Хлор | Cl | 17 | 35,453 |
| Хром | Cr | 24 | 51,9961 |
| Цезий | Cs | 55 | 132,9054 |
| Церий | Ce | 58 | 140,12 |
| Цинк | Zn | 30 | 65,39 |
| Цирконий | Zr | 40 | 91,224 |
| Эйнштейний | Es | 99 | (252) |
| Эрбий | Er | 68 | 167,26 |
| 1) В расчете на атомную массу изотопа углерода 12С, равную 12,0000. В круглых скобках указано массовое число наиболее долгоживущего нуклида. 2)См. также АТОМНАЯ МАССА. |
|||
Соединения
Элементы, соединяясь друг с другом, образуют сложные вещества – химические соединения. Соль, вода, ржавчина, каучук – это примеры соединений. Соединение состоит из элементов, но обычно по своим свойствам и внешнему виду не напоминает ни один из них. Так, ржавчина образуется при взаимодействии газа – кислорода с металлом – железом, а сырьем для получения многих волокон служат уголь, вода и воздух. Именно индивидуальность свойств – одна из черт, отличающих соединение от простой смеси. Другая, и наиболее важная, характеристика соединения заключается в том, что элементы всегда соединяются между собой в определенных массовых соотношениях. Например, вода состоит из 2,016 массовых частей водорода и 16,000 массовых частей кислорода. Массовое соотношение между водородом и кислородом в водах Волги и льдах Антарктики одинаково и равно 1:8. Иными словами, каждое химическое соединение имеет вполне определенный состав, т.е. всегда содержит одни и те же элементы в одних и тех же массовых соотношениях. Это один из основных химических законов – закон постоянства состава.
Многие элементы образуют несколько соединений. Так, помимо воды известно еще одно соединение водорода и кислорода – пероксид водорода, который состоит из 2,016 частей водорода и 32 частей кислорода. Здесь водород и кислород находятся в массовом соотношении 1:16, что ровно вдвое отличается от их соотношения в воде. Этот пример иллюстрирует закон кратных соотношений: если два элемента образуют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым количеством другого, относятся между собой как небольшие целые числа.
Атомы и молекулы
Понятия атомов и молекул – основные в химии. Атом – это мельчайшая частица элемента, обладающая всеми его свойствами, а молекула – мельчайшая частица соединения, обладающая его свойствами и способная к самостоятельному существованию. Атомистическая идея восходит к 6–5 вв. до н.э. и принадлежит древнегреческим философам Левкиппу и его ученику Демокриту. По их представлениям, вещество состоит из мельчайших неделимых частиц – атомов, созданных из одного и того же первичного материала. Правда, ни один из этих философов не определил, что это за материал. Впоследствии атомную теорию развил другой греческий философ, Эпикур (4–3 вв. до н.э.). Он утверждал, что атомы обладают весом и перемещаются в горизонтальном и вертикальном направлениях, взаимодействуя друг с другом. Аналогичные идеи высказывал римский поэт Лукреций в 1 в. до н.э., наблюдавший за пылинками, которые танцуют в солнечном луче. Наконец, в 1804–1810 английский химик и физик Дж.Дальтон разработал атомную теорию, которая включала законы кратных соотношений и постоянства состава. Однако убедительные доказательства существования атомов были получены только в 20 в. Когда Лукреций утверждал, что пылинки подталкиваются невидимыми потоками движущихся атомов, он был не так уж далек от истины: их танец действительно могут вызывать воздушные течения, но даже в неподвижном воздухе частички пыли или дыма находятся в постоянном движении. Этот эффект называют броуновским движением (см. также БРОУНОВСКОЕ ДВИЖЕНИЕ). Спустя два тысячелетия после Лукреция французский ученый Ж.Перрен, вооруженный микроскопом и математической теорией, изучил случайные блуждания суспендированных частичек краски и рассчитал число невидимых молекул, чьи удары заставляли их двигаться. После того, как атомы и молекулы удалось сосчитать, само их существование стало гораздо более убедительным.
Строение атома
Согласно современным представлениям, атом содержит центральное ядро, размеры которого очень малы по сравнению с атомом в целом. Ядро несет положительный электрический заряд и окружено диффузной оболочкой (облаком) из отрицательно заряженных электронов, которая и определяет размер атома. Диаметр атома – ок. 10–8 см, диаметр ядра в 10 000 раз меньше и равен примерно 10–12 см. У простейшего из атомов – атома водорода – в ядре всего одна частица – протон. Ядро атомов других элементов содержит более одного протона, а также нейтроны – частицы, близкие к протонам по массе, но не имеющие электрического заряда. Заряд ядра называют его атомным (или порядковым) номером. Атомный номер равен числу протонов в ядре и определяет химическую природу элемента. Так, атом с зарядом ядра +26 содержит 26 протонов в ядре и представляет собой элемент железо. Ядро атома железа окружают 26 электронов, поэтому атом в целом электронейтрален.
Суммарное число протонов и нейтронов в ядре называют массовым числом, поскольку в этих частицах сосредоточена практически вся масса атома. Число нейтронов, содержащихся в ядрах атомов данного элемента, в отличие от числа протонов, может варьировать. Атомы одного элемента, ядра которых содержат разное число нейтронов, называют изотопами. Слово «изотоп» греческого происхождения; оно означает «одно и то же место» – разные изотопы элемента занимают одну и ту же позицию в периодической таблице Менделеева (см. также ИЗОТОПЫ) и обладают очень близкими химическими свойствами. Так, у водорода (массовое число 1) есть изотоп дейтерий, в ядре которого один протон и один нейтрон (массовое число соответственно равно 2). Оба изотопа вступают в одни и те же химические реакции, но не всегда одинаково легко.
Термин «атомная масса» означает массу атома элемента, выраженную в единицах массы атома изотопа углерода 12С, которую принято считать равной его массовому числу – 12,0000 (атомная масса изотопа близка к его массовому числу, но не равна ему, поскольку при образовании атомного ядра часть массы теряется в виде энергии). До 1961 атомные массы элементов определяли относительно среднего массового числа для смеси изотопов кислорода, равного 16,0000. Атомная масса элемента, существующего в природе в виде смеси изотопов, – это средняя величина атомных масс всех изотопов с учетом их распространенности в природе (см. также АТОМНАЯ МАССА). Молекулярная масса равна сумме масс атомов элементов, составляющих молекулу. Например, мол. масса воды равна сумме 2 · 1,008 (два атома водорода) + 16,0000 (один атом кислорода), т.е. 18,016.
Электронное облако
Физические и химические свойства атомов, а следовательно, и вещества в целом во многом определяются особенностями электронного облака вокруг атомного ядра. Положительно заряженное ядро притягивает отрицательно заряженные электроны. Электроны вращаются вокруг ядра так быстро, что точно определить их местонахождение не представляется возможным. Движущиеся вокруг ядра электроны можно сравнить с облаком или туманом, в одних местах более или менее плотным, в других – совсем разреженным. Форму электронного облака, а также вероятность нахождения электрона в любой его точке можно определить, решив соответствующие уравнения квантовой механики (см. также КВАНТОВАЯ МЕХАНИКА). Области наиболее вероятного нахождения электронов называют орбиталями. Каждая орбиталь характеризуется определенной энергией, и на ней может находиться не более двух электронов. Обычно вначале заполняются ближайшие к ядру самые низкоэнергетические орбитали, затем орбитали с более высокой энергией и т.д.
Совокупность электронных орбиталей с близкой энергией образует слой (т.е. оболочку, или энергетический уровень). Энергетические уровни нумеруют, начиная от ядра атома: 1, 2, 3, ... . Чем дальше от ядра, тем просторнее слои и тем больше орбиталей и электронов они могут вместить. Так, на n-м уровне n2 орбиталей, и на них могут располагаться до 2n2 электронов. У известных элементов электроны находятся только на первых семи уровнях, и лишь первые четыре из них бывают заполненными.
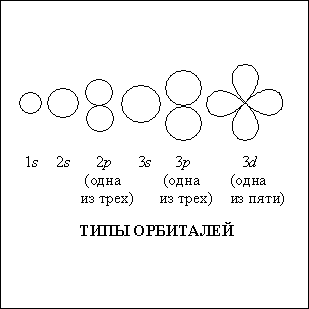
Существует четыре типа орбиталей, их обозначают s, p, d и f. На каждом уровне (слое) имеется одна s-орбиталь, которая содержит наиболее прочно связанные с ядром электроны. За ней следуют три p-орбитали, пять d-орбиталей и, наконец, семь f-орбиталей.
|
Оболочка n |
Число орбиталей n2 |
Тип орбиталей |
Число электронов 2n2 |
|
1 |
1 |
s |
2 |
|
2 |
4 |
s, p |
8 |
|
3 |
9 |
s, p, d |
18 |
|
4 |
16 |
s, p, d, f |
32 |
s-Орбитали имеют форму сферы, p – форму гантели или двух соприкасающихся сфер, у d-орбиталей – 4 «лепестка», а у f-орбиталей – 8. В разрезе эти орбитали выглядят примерно так, как показано на рисунке.
Три р-орбитали ориентированы в пространстве вдоль осей прямоугольной системы координат и обозначаются соответственно px, py и pz; d- и f-орбитали тоже располагаются под определенными углами друг к другу; сферические s-орбитали пространственной ориентации не имеют.
Каждый следующий элемент в периоде имеет атомный номер, на единицу превышающий номер предыдущего элемента, и содержит на один электрон больше. Этот дополнительный электрон занимает следующую орбиталь в порядке возрастания. Нужно иметь в виду, что электронные слои диффузны и энергия у некоторых орбиталей наружных слоев ниже, чем у внутренних. Поэтому, например, сначала заполняется s-орбиталь четвертого уровня (4s-орбиталь), и только после нее завершается заполнение 3d-орбитали. Порядок заполнения орбиталей, как правило, следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s. В записи, которую используют для представления электронной конфигурации элемента, верхний индекс при букве, обозначающей орбиталь, указывает число электронов на этой орбитали. Например, запись 1s22s22p5 означает, что на 1s-орбитали атома находится два электрона, на 2s-орбиталях – два, на 2р – пять электронов. Нейтральные атомы, имеющие на внешней электронной оболочке 8 электронов (т.е. заполнены s- и р-орбитали), настолько стабильны, что практически не вступают ни в какие химические реакции. Таковы атомы инертных газов. Электронная конфигурация гелия 1s2, неона – [1s2]2s22p6, аргона – [1s22s22p6]3s23p6, криптона – [1s22s22p63s23p6]4s23d104p6, ксенона – [1s22s22p63s23p64s23d104p6]5s24d105p6 и, наконец, радона – [1s22s22p63s23p64s23d104p65s24d105p6]6s24f145d 106p6.
Металлы и неметаллы
Почти все металлы – твердые блестящие вещества, они хорошо проводят электрический ток, ковкие и пластичные, с помощью литья из них можно получать изделия практически любой формы. Многие неметаллы – газы; твердые же неметаллы, как правило, хрупкие, иногда прозрачные и не проводят электричества. Различия в свойствах металлов и неметаллов становятся понятными, если знать строение их атомов, их электронную конфигурацию. Внешняя электронная оболочка атомов металлов заполнена меньше чем наполовину, поэтому, вступая в химические реакции, все металлы стремятся избавиться от внешних электронов, приобретая стабильную электронную конфигурацию. Таким образом, они склонны образовывать положительные ионы. Именно эти внешние (подвижные) электроны отвечают за электропроводность металлов, а также за их механические свойства. Напротив, внешняя электронная оболочка атомов неметаллов практически заполнена. К неметаллам, в частности, относятся инертные газы, у которых на внешней электронной оболочке максимальное число электронов: у гелия два, у остальных восемь. В химических реакциях неметаллы либо присоединяют электроны, превращаясь в отрицательные ионы, либо образуют ковалентную связь.
|
Один валентный электрон |
Два валентных электрона |
Шесть валентных электронов (группа 6, халькогены) |
Семь валентных электронов (группа 7, галогены) |
|||||||||
| (1 | Водород | Н+) | 4 | Бериллий | Ве2+ | 8 | Кислород | O2– | (1 | Водород | H–) | |
| 3 | Литий | Li+ | 12 | Магний | Mg2+ | 16 | Сера | S2– | 9 | Фтор | F– | |
| 11 | Натрий | Na+ | 20 | Кальций | Ca2+ | 34 | Селен | Se2– | 17 | Хлор | Cl– | |
| 19 | Калий | К+ | 38 | Стронций | Sr2+ | 52 | Теллур | Te2– | 35 | Бром | Br– | |
| 37 | Рубидий | Rb+ | 56 | Барий | Ва2+ | 84 | Полоний | Po2– | 53 | Иод | I– | |
| 55 | Цезий | Cs+ | ||||||||||
ХИМИЧЕСКИЕ СВЯЗИ, ФОРМУЛЫ И УРАВНЕНИЯ
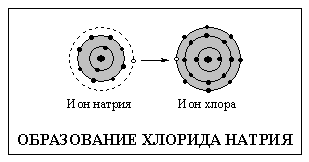
Элементы, не обладающие стабильной электронной конфигурацией инертных газов, стремятся приобрести ее, вступая в химические реакции. Атомы, которым до стабильной конфигурации не хватает незначительного числа электронов или, напротив, у которых имеется небольшой их избыток, обычно образуют электрически заряженные частицы – ионы. Положительно заряженные ионы (образующиеся при потере электронов) называют катионами, отрицательно заряженные ионы (образующиеся при приобретении электронов) – анионами. Заряд ионов редко превышает 3, т.е. атомы редко теряют или приобретают более трех электронов. Атом натрия (см. схему), соединяясь с атомом хлора, теряет один наружный электрон и превращается в катион, а атом хлора приобретает этот электрон и становится анионом. Их внешние электронные оболочки становятся заполненными и содержат по восемь электронов. Катион и анион притягиваются, образуя хлорид натрия.
Электроны внешней оболочки, участвующие в образовании химических связей, называют валентными. (Валентность элемента равна числу связей, которые он способен образовать.) Некоторые элементы и их валентные электроны перечислены в приведенной выше таблице. В ней также указаны атомные номера элементов и наиболее распространенные ионы. Элементы, имеющие одинаковую электронную конфигурацию внешних оболочек и обладающие сходными физическими и химическими свойствами, объединены в периодической системе элементов в группы от I до VIII, причем номер группы совпадает с числом валентных электронов.
Периодическая система элементов помогает понять, чем объясняется сходство элементов, принадлежащих данной группе, и почему эти элементы все-таки отличаются друг от друга. Открытие периодического закона и публикация периодической системы русским химиком Д.И.Менделеевым в 1869 явились важнейшим этапом в систематизации свойств известных и предсказании еще неоткрытых химических элементов.
См. также ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ.
Ионная связь
Противоположно заряженные ионы притягиваются друг к другу и сближаются, но лишь до определенного предела. Когда расстояние между ионами становится слишком мало, их электронные облака начинают отталкиваться, и дальнейшее сближение становится невозможно. Таким образом, есть определенное расстояние, на котором ионная пара наиболее стабильна. Его называют длиной ионной связи. Пространственное расположение заряженных частиц в веществе, имеющем ионный характер состояния, строго упорядоченно. В качестве примера ионных соединений можно привести обычную поваренную соль NaCl, в которой ион натрия Na+ связан с ионом хлора Cl–, или хлорид кальция CaCl2 с соотношением между ионами кальция Са2+ и хлорид-ионами Cl– 1:2. Как NaCl, так и CaCl2 электрически нейтральны.
Ковалентная связь
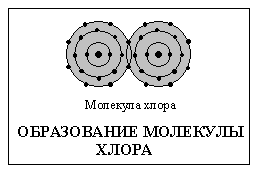
Другой распространенный тип связи – ковалентная связь – возникает, когда два атома обобществляют одну (или более) пару электронов. При образовании ковалентной связи атомы удерживаются вместе электростатическим притяжением ядер к общей электронной паре, в отличие от ионной связи, в основе которой лежит электростатическое притяжение между самими ионами. Ковалентные связи обычно образуются в тех случаях, когда ядра атомов притягивают электроны примерно с одинаковой силой. Такая связь существует, например, в молекуле хлора (см. схему). Есть удобное правило для определения типа связи между атомами двух элементов: если один элемент находится в левой части периодической таблицы, а другой – в правой, то связь между ними будет ионной (см. элементы, перечисленные в приведенной выше таблице).
Если валентные электроны обозначить точками, то различие между двумя типами связи станет более наглядным:
Соединения типа LiF, BeO или BeF2 ионные. Соединения, молекулы которых состоят из элементов – соседей по периодической таблице, как правило, ковалентные (CO2, CF4, NO2, N2, O2, F2). Правда, некоторые металлы образуют как ионные, так и ковалентные соединения.
Два атома могут иметь две или даже три общие электронные пары, образуя двойную или тройную связь:
Полярная связь
Между чисто ковалентной (Cl2) и чисто ионной (LiF) связями есть еще одна, промежуточная. Она образуется, когда разные атомы притягивают общую электронную пару с неодинаковой силой. Способность атома оттягивать на себя электроны, участвующие в образовании химической связи, называется электроотрицательностью. Между атомами с существенно разной электроотрицательностью образуется чисто ионная связь; по мере уменьшения различий в электроотрицательности связь приобретает ковалентную «компоненту» и, наконец, становится чисто ковалентной. Электроотрицательность атомов хлора в молекуле Cl2 одинакова, поэтому связь между ними ковалентная. Связь Н–О в молекуле воды имеет в некоторой степени ионный характер, поскольку кислород более электроотрицателен, чем водород, и оттягивает на себя электронную пару. Такие связи называют полярными, причем полярность связи возрастает по мере увеличения ее ионного характера.
| ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (ШКАЛА ПОЛИНГА) | ||||||
| H | ||||||
| 2,1 | ||||||
| Li | Be | B | C | N | O | F |
| 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 |
| Na | Mg | Al | Si | P | S | Cl |
| 0,9 | 1,2 | 1,5 | 1,8 | 2,1 | 2,5 | 3,0 |
| K | Ca | Ga | Ge | As | Se | Br |
| 0,8 | 1,0 | 1,6 | 1,8 | 2,0 | 2,4 | 2,8 |
| Rb | I | |||||
| 0,8 | 2,5 | |||||
| Cs | ||||||
| 0,7 | ||||||
Степень окисления
Полярность связи Н–О иллюстрирует концепцию окисления (полной или частичной отдачи электронов), весьма полезную для наглядной иллюстрации картины распределения обобществленных электронов для механизма некоторых химических реакций. Атом кислорода сильнее притягивает общую электронную пару, поэтому можно сказать, что он как бы приобретает один лишний электрон за счет атома водорода. Обычно атом кислорода образует две связи, как в молекуле Н2О, следовательно, притягивает к себе два электрона и обладает степенью окисления –2. Поскольку атом водорода как бы теряет один электрон, его степень окисления +1. Степень окисления кислорода отличается от –2 в соединениях, называемых пероксидами, например в пероксиде водорода Н2О2. Здесь каждый атом кислорода делит один электрон с другим атомом и принимает от атома водорода один электрон. Поэтому степень окисления кислорода в пероксиде водорода –1. Степень окисления отдельного атома или молекулы (Mg, Cl2, O2) равна нулю. В нейтральном соединении сумма степеней окисления всех атомов равна нулю, в заряженном – суммарному заряду.
Эти правила позволяют вычислить степень окисления атома в каждом конкретном соединении. В молекуле SO2 два атома кислорода в сумме дают степень окисления –4, а поскольку суммарная степень окисления молекулы должна равняться нулю, то степень окисления S равна +4. В анионе SO42– степень окисления серы +6, а в H2S она равна –2. Более электроотрицательному элементу приписывают знак минус.
Формулы
Поскольку количества атомов в молекуле относятся между собой как небольшие целые числа, состав молекулы можно представить, используя символы химических элементов и цифры, показывающие число атомов каждого элемента. Так, молекула воды, которая состоит из двух атомов водорода и одного атома кислорода, имеет формулу Н2О; пероксид водорода, в молекуле которого по два атома каждого элемента, – Н2О2. Формула оксида углерода – СО, диоксида – СО2, поскольку в молекулах этих соединений содержатся соответственно один атом углерода и один атом кислорода или один атом углерода и два атома кислорода. Формула FeSO4 отвечает сульфату железа(II); в молекуле этого соединения по одному атому железа и серы и четыре атома кислорода. Совокупность атомов, образующих определенную группу, обычно характеризуют одним словом. Например, SO42– – это сульфатная группа, она входит в состав таких соединений, как сульфат алюминия Al2(SO4)3 и сульфат железа(III) Fe2(SO4)3. Другой пример – нитратная группа NO3–, входящая в состав нитрата аммония NH4NO3.
Ионы изображают, добавляя к символу элемента или группы знак «+» или «–». Например, Na+ – это ион натрия, Cl– – хлорид-ион, SO42– – сульфат-ион, Fe2+ – ион железа(II), Fe3+ – ион железа(III). Последние два иона получены из атома железа удалением двух и трех электронов соответственно.
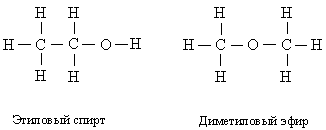
Структурные формулы
наглядно показывают, из каких атомов состоят молекулы и какими связями они соединены; общие электронные пары или ковалентные связи обозначают черточками. В качестве примера рассмотрим этиловый спирт. Его обычная химическая формула С2Н5ОН. Такую же формулу имеет другое соединение – диметиловый эфир, и различие между этими соединениями можно увидеть, только записав их структурные формулы:
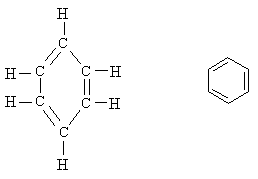
Конечно, такие формулы занимают больше места, чем обычные (CH3 –CH2 –OH и СН3 –О–СН3 или С2Н5ОН и СН3ОСН3). Поэтому в структурных формулах циклических соединений углерода химические символы часто опускают, изображая только кольцо из связей между атомами углерода. Ниже представлены полная структурная формула бензола (слева) и бензольное кольцо (справа):
Уравнения
Химические реакции можно представить в виде уравнений; при этом химические формулы реагентов находятся в левой части, продуктов реакции – в правой, а между ними стоит знак равенства (=), однонаправленная (→) или двунаправленная ↔ стрелка или двойные стрелки  . Знак равенства означает, что из данных веществ образуются другие, а двунаправленная стрелка или двойные стрелки указывают, что реакция может протекать в обоих направлениях и между реагентами и продуктами устанавливается динамическое равновесие. Одинарная стрелка иногда заменяет знак равенства, но чаще означает, что реакция идет только в одном направлении. Таким образом, уравнение 2Cl
. Знак равенства означает, что из данных веществ образуются другие, а двунаправленная стрелка или двойные стрелки указывают, что реакция может протекать в обоих направлениях и между реагентами и продуктами устанавливается динамическое равновесие. Одинарная стрелка иногда заменяет знак равенства, но чаще означает, что реакция идет только в одном направлении. Таким образом, уравнение 2Cl  Cl2 говорит о том, что два атома хлора, соединяясь, образуют молекулу и реакция может протекать в обратном направлении. На эту реакцию, как и на многие другие, влияют условия, в которых ее проводят, например температура. В реакции 2Cl
Cl2 говорит о том, что два атома хлора, соединяясь, образуют молекулу и реакция может протекать в обратном направлении. На эту реакцию, как и на многие другие, влияют условия, в которых ее проводят, например температура. В реакции 2Cl  Cl2 молекула хлора образуется при комнатной температуре, а атомарный хлор – при более высокой. Иногда эти условия указывают над стрелкой. Так, вместо приведенной выше реакции можно записать:
Cl2 молекула хлора образуется при комнатной температуре, а атомарный хлор – при более высокой. Иногда эти условия указывают над стрелкой. Так, вместо приведенной выше реакции можно записать:
Если реакционную смесь нагревают, то над стрелкой иногда ставят греческую букву дельта, D. Физическое состояние реагентов и продуктов реакции указывают буквами г., ж., тв., водн., что означает соответственно газ, жидкость, твердое тело, водный раствор. Таким образом, уравнение
показывает, что при нагревании водного раствора бикарбоната кальция образуются твердый осадок карбоната кальция, газообразный диоксид углерода и вода (в виде паров или жидкости в зависимости от температуры).
См. также ХИМИЧЕСКОЕ УРАВНЕНИЕ.
Сбалансированные уравнения
Реакцию между серной кислотой и гидроксидом натрия с образованием сульфата натрия и воды можно записать в виде NaOH + H2SO4 = H2O + Na2SO4. В действительности это уравнение не точное, поскольку число атомов одного и того же элемента в обоих частях равенства должно быть одинаковым, здесь же в левой части один атом натрия, а справа – два. Чтобы уравнять число атомов Na, перед NaOH нужно поставить коэффициент 2; аналогичным образом следует уравнять число атомов водорода и кислорода. В результате уравнение примет вид
Подобные процедуры необходимо проводить до того, как уравнение будет использоваться для каких-либо вычислений.
Ионные уравнения
Многие вещества в растворе диссоциируют на ионы, которые могут вступать в химические реакции. В качестве примера рассмотрим приведенную выше реакцию между растворенными в воде гидроксидом натрия и серной кислотой. Реакция, записанная в ионной форме, будет иметь вид
Ионизация воды здесь не показана. Отметим, что число ионов натрия и сульфат-ионов не изменяется, взаимодействуют только гидроксильные ионы и ионы водорода, поэтому суммарную реакцию можно записать в виде
или еще проще
Массовые соотношения
Зная химическую формулу соединения и атомные массы, можно найти соотношения между массами элементов, входящих в состав соединения. Рассмотрим соединение Fe2O3 – оксид железа(III), обычную ржавчину. Найдем в периодической таблице атомные массы элементов и сложим их:
Доля железа в оксиде железа(III) составляет 111,6940/159,6922 = 0,6994, или 69,94%. 159,6922 – это мол. масса оксида железа(III).
См. также МОЛЕКУЛЯРНАЯ МАССА.
Распространив этот принцип на химические уравнения, можно рассчитать, какое количество каждого из реагентов необходимо взять для того, чтобы по завершении реакции ни один из них не остался неизрасходованным, а также оценить, сколько разных продуктов образуется в ходе реакции. Так, в реакции окисления железа
4·55,8470 = 223,3880 г железа взаимодействуют с 6·15,9994 = 95,9964 г кислорода, образуя 319,3844 г оксида железа(III). Зная количество железа, всегда можно рассчитать массу образовавшегося из него оксида.
Объемы газов и химические реакции
При постоянных давлении и температуре объемы реагирующих друг с другом газов, а также объемы газообразных продуктов реакции относятся как небольшие целые числа (закон Гей-Люссака). Эти отношения равны коэффициентам соответствующего химического уравнения. Рассмотрим, например, горение метана СН4, основного компонента природного газа. Как следует из уравнения реакции СН4 + 2О2 = СО2 + 2Н2О, для поддержания горения одного объема метана требуются два объема кислорода, а в результате образуются один объем диоксида углерода и два объема воды. Все объемы, конечно, приведены к одинаковым температуре и давлению.
ФИЗИЧЕСКИЕ СВОЙСТВА
Рассмотрим некоторые физические свойства вещества: агрегатное состояние, температуры плавления и кипения, кристаллическую структуру, электропроводность.
Агрегатное состояние
вещества определяется силой притяжения между составляющими его молекулами и температурой. В твердом теле молекулы достаточно сильно сцеплены друг с другом и их движение ограничивается колебаниями относительно фиксированных положений. С повышением температуры энергия молекул увеличивается, колебания становятся все более интенсивными, и в конце концов молекулы приобретают достаточно энергии, чтобы совершать поступательные движения. При этом твердое вещество плавится (если межмолекулярное взаимодействие остается достаточно сильным) или, сублимируясь, превращается в газ, молекулы которого движутся хаотически.
Температура плавления
(затвердевания) – это температура, при которой твердое вещество превращается в жидкость (или жидкость превращается в твердое вещество). Температура плавления воды равна 0° С (по шкале Цельсия) или 32° F (по шкале Фаренгейта). Поскольку при плавлении объем тела меняется незначительно, давление мало влияет на температуру плавления. Однако именно под действием высокого давления, оказываемого полозом конька, лед расплавляется, и спортсмен легко скользит по нему.
Температура кипения
– это температура, при которой жидкость превращается в пар (газ). Она зависит от давления, поэтому в горах вода кипит при более низкой температуре, чем на уровне моря. Температура кипения воды при давлении 760 мм рт. ст. («стандартном» давлении, примерно равном давлению на уровне моря) составляет 100° С (или 212° F).
Кристаллические и аморфные вещества
Твердые вещества бывают аморфными и кристаллическими. У аморфных молекулы расположены случайным образом. В качестве примера аморфного вещества можно привести стекло. Как и другие подобные вещества, стекло не имеет определенной температуры плавления: при нагревании оно постепенно размягчается, пока, наконец, не становится жидким. Напротив, молекулы (или ионы) кристаллических веществ расположены строго упорядоченно. К кристаллическим веществам относятся песок, поваренная соль, сахар, алмаз, графит и т.п. Все они плавятся при определенной температуре (если только при нагревании не претерпевают никаких химических изменений, как это случается с сахаром). Многие ионные соединения (например, поваренная соль NaCl) образуют кристаллы, в которых каждый ион окружен противоположно заряженными ионами; в результате нельзя сказать, что какая-то конкретная пара ионов образует молекулу.
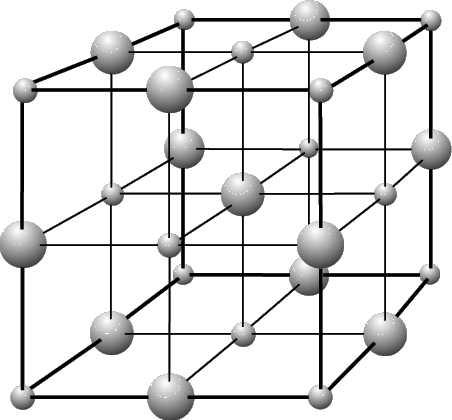
Вследствие взаимного притяжения ионов в кристалле поваренной соли (NaCl) это вещество плавится при высокой температуре (801° С). Каждый ион NaCl окружен шестью ближайшими соседями, имеющими противоположный заряд. Элементарная ячейка кристалла поваренной соли – это куб, у которого по углам и в центре каждой грани расположены ионы натрия. Ячейка такого типа называется гранецентрированной кубической. Кубическую форму имеют и крупные кристаллы поваренной соли.
Кристаллическая решетка алмаза, в которой каждый атом углерода ковалентно связан с четырьмя соседними атомами, также характеризуется гранецентрированной кубической элементарной ячейкой. Алмаз – очень твердое вещество, имеющее высокую температуру перехода.
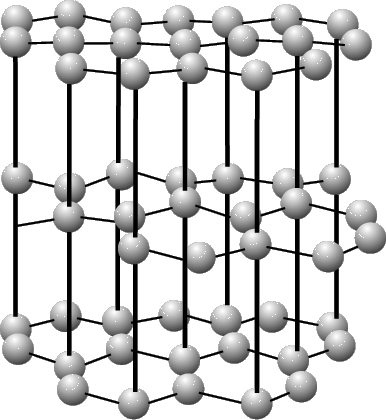
Совсем по-другому расположены атомы углерода в графите. Здесь они образуют слои, не очень прочно связанные друг с другом. Каждый слой «выстлан» шестиугольниками из углеродных атомов, аналогичными бензольному кольцу. Поскольку сцепление между слоями довольно слабое, графит мягкий. Слои легко скользят один относительно другого, благодаря чему графит является хорошим смазочным материалом. Разные кристаллические формы одного и того же элемента, такие, как графит и алмаз, называют аллотропами.
См. также АЛЛОТРОПИЯ.
Вещества, молекулы которых удерживаются вместе слабыми силами притяжения, а не ковалентными или ионными связями, плавятся при относительно низких температурах, редко превышающих 400° С. Таково большинство органических соединений, а также ковалентные неорганические. В качестве примеров можно привести воду и бензол: температура их плавления значительно ниже комнатной.
Электропроводность
Металлы – прекрасные проводники электричества. Носителями электрического тока в них являются электроны, свободно «плавающие» в кристаллической решетке между ионами металла, занимающими фиксированное положение в узлах решетки. Эти электроны компенсируют взаимное отталкивание положительных ионов и стабилизируют всю структуру. Если к металлу приложить разность потенциалов, то электроны будут перемещаться к положительному полюсу и возникнет электрический ток.
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
К неорганическим относятся соединения всех химических элементов, за исключением большинства соединений углерода.
Кислоты, основания и соли
Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти ионы определяют характерные свойства сильных кислот: кислый вкус и способность взаимодействия с основаниями. Основания – это вещества, которые в воде диссоциируют с высвобождением гидроксид-ионов (ОН–). Солями называют ионные соединения, образующиеся при взаимодействии кислот и оснований:
Номенклатура неорганических соединений
Номенклатура большинства распространенных неорганических соединений основана на следующих правилах.
Элементы
Названия металлов обычно кончаются на -ий (например, натрий, калий, алюминий, магний). Исключение составляют металлы, известные с древности и тогда же получившие свои названия. Это, например, железо, медь, золото. Названия неметаллов, как правило, кончаются на -ор (хлор, бор, фосфор), -од (водород, кислород, иод) или -он (аргон, неон). Зная названия элементов и наиболее распространенных ионов и используя приведенные ниже правила, можно дать название практически любому неорганическому соединению.
Кислоты
Названия кислот, молекулы которых не содержат кислорода, оканчиваются на водородная, например хлороводородная (HCl), бромоводородная (HBr), иодоводородная (HI).
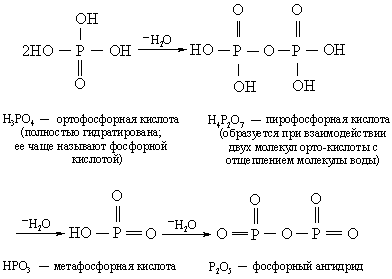
Названия кислородсодержащих кислот зависят от степени окисления центрального элемента. Название той кислоты, в которой этот элемент имеет меньшую степень окисления, оканчивается на -истая, например азотистая (HNO2), сернистая (H2SO3), а бóльшую – на -ная, например азотная (HNO3), серная (H2SO4). На примере хлора рассмотрим случай, когда элемент образует более двух кислородсодержащих кислот. Их названия формируются следующим образом: хлорноватистая кислота, HClO; хлористая, HClO2; хлорноватая, HClO3; хлорная, HClO4. Степень окисления хлора здесь составляет +1, +3, +5 и +7 соответственно. Названия кислот, молекулы которых содержат разное количество воды, отличаются друг от друга приставками орто-, гипо-, пиро- и мета- (в порядке уменьшения содержания воды):
Положительно заряженные ионы
Названия этих ионов образуются следующим образом: после слова ион указывают название элемента и римскими цифрами – степень его окисления. Например, Cu2+ – ион меди(II), Cu+ – ион меди(I). Названия некоторых положительных ионов оканчиваются на -оний: аммоний, NH4+; гидроксоний, H3O+.
Отрицательно заряженные ионы
Названия одноатомных отрицательно заряженных ионов (и соответственно солей), полученных из не содержащих кислорода кислот, оканчиваются на -ид: хлорид-ион, Cl–; бромид-ион, Br–. Названия ионов (и соответственно солей), полученных из кислородсодержащих кислот, в которых центральный элемент имеет меньшую степень окисления, оканчиваются на -ит: сульфит, SO32–; нитрит, NO2–; фосфит, PO33–; а бóльшую – на -ат: сульфат, SO42–; нитрат, NO3–; фосфат, РО43–. Названия ионов, полученных из частично нейтрализованных кислот, образуются прибавлением к названию иона слова кислый либо приставок гидро- или би-: гидрокарбонат (бикарбонат), HCO3–; кислый сульфат, HSO4–.
Соли и ковалентные соединения
Для солей и ковалентных соединений используют названия ионов, которые в них входят: хлорид натрия, NaCl; гидроксид натрия, NaOH. Если элемент может иметь несколько степеней окисления, то после его названия римскими цифрами указывают степень окисления в данном соединении: сульфат железа(II), FeSO4; сульфат железа(III), Fe2(SO4)3. Если соединение образуют два неметалла, то для указания числа их атомов используют приставки ди-, три-, тетра-, пента- и т.д. Например, дисульфид углерода, CS2; пентахлорид фосфора, PCl5, и т.д.
РАСТВОРЫ И РАСТВОРИМОСТЬ
Благодаря неравномерному распределению электрического заряда в молекулах, т.е. наличию у них отрицательных и положительных «полюсов» (если говорить более строго – дипольного момента), даже нейтральные в целом молекулы притягиваются друг к другу. Сила этого притяжения зависит от степени локализации заряда и определяет способность жидкостей растворять различные вещества. Как правило, полярные молекулы достаточно сильно притягиваются друг к другу; именно поэтому спирт и вода легко смешиваются. Взаимное притяжение неполярных молекул гораздо слабее. Примерами неполярных соединений служат тетрахлорид углерода CCl4 и углеводороды, например бензол.
Растворимость
Растворение начинается с того, что молекулы растворителя «прокладывают себе путь» между молекулами растворяемого вещества. Это может происходить только в том случае, если силы притяжения между молекулами растворителя, с одной стороны, и растворителя и растворяемого вещества – с другой, примерно одинаковы. Отсюда следует правило растворимости: подобное растворяется в подобном (имеется в виду «подобное» по полярности). Вода и бензин не смешиваются, поскольку полярные молекулы воды сильно притягиваются друг к другу и молекулы углеводорода не могут проникнуть между ними. В то же время бензин легко смешивается с тетрахлоридом углерода, причем и тот, и другой служат хорошими растворителями для многих нерастворимых в воде неполярных веществ, таких, как жиры или парафины. Вода, в свою очередь, растворяет большинство ионных веществ, например поваренную соль или питьевую соду (гидрокарбонат натрия NaHCO3), а также полярные неионные соединения, такие, как спирт, сахар (молекула которого содержит множество ОН-групп), крахмал и витамин С. Ни одно из этих веществ не растворяется ни в бензине, ни в других углеводородах.
При растворении ионных соединений в воде или других полярных растворителях ионы «вытягиваются» из кристаллической решетки силами притяжения молекул растворителя:
при этом они сольватируются, т.е. более или менее прочно связываются с молекулами растворителя (в уравнении это не отражено), так что, например, ионы натрия находятся в виде Na+(H2O)x. Хорошо растворимый в воде газ хлороводород тоже диссоциирует на ионы водорода и хлорид-ионы:
Молекулы воды притягивают ионы водорода, и образуются ионы гидроксония Н3О+. Менее полярные соединения (спирты или сахара и т.п.) в воде почти не диссоциируют.
Иногда вещество начинает растворяться в результате химической реакции, которая изменяет его свойства. Так, мрамор (или известняк СаСО3) в чистой воде практически нерастворим, но растворяется в воде подкисленной:
СаСО3 (тв.) + 2HCl (водн.) → CaCl2 (водн.) + CO2 (г.) + H2O (ж.)
Молекулы некоторых твердых веществ настолько прочно связаны друг с другом, что эти вещества не растворяются ни в одном растворителе, за исключением тех, с которыми взаимодействуют химически. В качестве примеров можно привести алмаз, графит, стекло и песок.
Влияние температуры и давления
Растворимость жидкостей и твердых веществ обычно увеличивается при повышении температуры, поскольку при этом возрастает энергия движения (кинетическая энергия) молекул и уменьшается их взаимное притяжение. Изменение давления мало влияет на растворимость, так как объем при растворении меняется незначительно.
Гораздо больше давление влияет на растворимость газов. Газ лучше растворяется при увеличении давления, под действием которого часть его молекул переходит в раствор. При повышении температуры растворимость газов снижается – кинетическая энергия молекул возрастает, они быстрее движутся и легче «вырываются» из растворителя.
См. также РАСТВОРЫ.
Электролиты
Некоторые растворы, как и металлы, проводят электрический ток. В этом случае носителями заряда служат ионы. Вещества, раствор которых проводит электрический ток, носят общее название электролитов, не проводящие – неэлектролитов.
См. также ЭЛЕКТРОЛИТЫ.
Концентрация
– это количество растворенного вещества, содержащееся в единице массы или объема раствора. Ее можно выразить в таких единицах, как, например, г/л (число граммов вещества в литре раствора). Иногда концентрацию измеряют в процентах. При этом необходимо указывать, какие проценты имеются в виду: весовые или объемные. Например, 10%-ный раствор спирта в воде – это раствор, содержащий 10 объемов спирта и 90 объемов воды (объемные проценты), а 10%-ный раствор хлорида натрия в воде – раствор, в котором на 10 массовых единиц вещества приходится 90 массовых единиц воды (массовые проценты). Когда количество растворенного вещества очень мало, используют единицу «миллионная доля» – одна часть растворенного вещества на миллион частей раствора (в англоязычной литературе ее обозначают ppm, в русской – м.д. или млн–1). Для описания химических реакций удобнее выражать концентрацию в виде числа молекул или ионов растворенного вещества на единицу объема раствора.
Моль
Моль – одна из семи основных единиц Международной системы единиц (СИ). Ее определяют как количество вещества, которое содержит столько же атомов, молекул или ионов, сколько 12 г изотопа углерода 12С (см. выше), а именно 6,022·1023 (число Авогадро). Понятие моля позволяет подсчитать, сколько частиц (атомов или молекул) вещества содержится в том или ином его массовом количестве. Например, из определения моля следует, что 6 г изотопа углерода 12С должны содержать 3,011·1023 атомов. Кроме того, из определения атомной массы известно, что количество граммов любого элемента, численно равное его атомной массе, содержит число Авогадро атомов этого элемента. Таким образом, 4,0026 г гелия, 32,06 г серы и 200,59 г ртути содержат одинаковое число атомов соответствующего элемента, а именно 6,022·1023. Аналогично, для веществ, состоящих из молекул, моль вещества – это такое его количество, масса которого в граммах численно равна молекулярной массе вещества. Таким образом, моль хлора Cl2 имеет массу 35,453·2 = 70,906 г, моль хлорида натрия NaCl – (22,9898 + 35,453) = 58,443 г, а моль ионов натрия Na+ – 22,9898 г.
Молярность
Молярность – это концентрация вещества в растворе, выраженная в молях растворенного вещества, содержащихся в 1 л раствора. Так, децимолярный (сокращенно 0,1 М) раствор хлорида натрия содержит 0,1 моль (или 5,8443 г) NaCl в 1 л раствора.
Моляльность
Моляльность – это число молей растворенного вещества в 1000 г растворителя. Так, 0,1-моляльный раствор хлорида натрия в воде содержит 0,1 моль (или 5,8443 г) NaCl в 1000 г Н2О. Эта единица используется реже, чем молярность.
Нормальность
Нормальность – это число эквивалентов вещества, содержащихся в 1 л раствора. Для систем, в которые входят кислоты, основания и соли, эквивалент – это количество вещества, которое расходуется при взаимодействии с 1 моль ионов водорода Н+. Например, при образовании моля сульфата натрия Na2SO4 (1 моль = 142,0412 г) 1 моль серной кислоты теряет 2 моля Н+. Таким образом, 1 моль сульфата натрия содержит 2 эквивалента, и нормальность одномолярного раствора сульфата натрия равна двум (2 н.).
См. также ЭКВИВАЛЕНТНАЯ МАССА.
ГАЗОВЫЕ ЗАКОНЫ
Поведение идеальных газов описывают следующие законы: 1) при постоянной температуре изменение объема газа обратно пропорционально изменению давления (закон Бойля – Мариотта); 2) при постоянном давлении изменение объема газа прямо пропорционально изменению абсолютной температуры (закон Шарля – Гей-Люссака); 3) при постоянных температуре и давлении изменение объема прямо пропорционально изменению количества вещества (закон Авогадро). Эти законы можно представить в виде одного уравнения состояния идеального газа PV = nRT, где Р – давление газа (Па), V – его объем (м3), Т – абсолютная температура (К), n – число молей газа, R – универсальная газовая постоянная, равная 8,314 Дж/K·моль (R = 0,08206 л·атм/К·моль, если P измеряют в атмосферах, V – в литрах, n – в молях, T – в кельвинах).
Если два газа смешать при постоянных температуре и давлении, то объем смеси будет равен сумме объемов газов, ее составляющих; при постоянном объеме давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь (закон парциальных давлений, установленный Дальтоном). Парциальное давление – это давление компонента идеальной газовой смеси, которое он оказывал бы, если бы один занимал объем всей смеси. Мольная доля одного из компонентов газовой смеси – это та часть всех молекул газа, которую составляют молекулы данного компонента. Для любого газа в смеси
Газы, поведение которых строго следует приведенному выше общему уравнению, называются идеальными. К ним близки инертные и другие газы, имеющие очень низкую температуру кипения (например, водород, кислород и азот). Газы с высокой температурой кипения, такие, как диоксид углерода, подчиняются законам идеальных газов весьма приближенно.
Представленные выше газовые законы основываются на допущении, что молекулы (или атомы) газа не имеют объема и не взаимодействуют друг с другом. Первое предположение не очень далеко от реальности, поскольку газ занимает значительно больший объем, чем жидкость такой же массы (объем жидкости есть мера объема ее молекул). Второе допущение тоже представляется разумным, поскольку, если бы молекулы газа достаточно сильно взаимодействовали, произошла бы конденсация. Если газ заключить в замкнутый сосуд, то его давление будет определяться энергией молекул, бомбардирующих стенки. Поскольку молекулы всех газов при одинаковой температуре обладают одинаковой кинетической энергией (температура – мера этой энергии), равные количества молекул будут оказывать одинаковое давление на стенки сосуда независимо от того, какому газу они принадлежат. А.Авогадро предположил, что занимаемый газом объем тоже определяется только числом молекул, а не их природой, и он тем больше, чем ниже давление или выше температура, но не зависит от размера или массы молекул газа как таковых, поскольку они очень малы. Между числом молекул и объемом газа существует следующее количественное соотношение: один моль любого газа содержит 6,022•1023 молекул и при нормальных условиях (0° С и 760 мм рт. ст.) занимает объем 22,4 л (см. АВОГАДРО ЧИСЛО).
ХИМИЧЕСКИЕ РЕАКЦИИ
Равновесие
Вещества вступают в химические реакции потому, что при этом уменьшается энергия системы, т.е. электронная конфигурация продуктов реакции оказывается энергетически более выгодной, чем конфигурация исходных реагентов. (Правда, есть еще один фактор – энтропийный; см. также ТЕРМОДИНАМИКА.) При большой разности энергий (т.е. большом различии в стабильности исходных реагентов и продуктов) реакция происходит мгновенно. Например, если кислород и водород смешать в определенном соотношении и смесь поджечь, то газы прореагируют мгновенно без остатка с образованием воды:
2H2 + O2 → 2H2O
Молекула воды стабильнее, чем смесь водорода и кислорода, поскольку прочность двух связей О–Н больше, чем суммарная прочность связей Н–Н и О–О. Прочность связи определяется той энергией, которая выделяется при ее образовании.
См. также ТЕПЛОТА; ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА.
Если разность энергий исходных реагентов и конечных продуктов химической реакции невелика, то в реакционной смеси присутствуют в заметных количествах и те, и другие, причем по прошествии определенного времени между ними устанавливается равновесие. В качестве примера можно привести растворение уксусной кислоты в воде:
H2O + CH3COOH → H3O+ + CH3COO-
(Атомы водорода в группе СН3 соединены с атомом углерода прочными ковалентными связями и не являются кислотными.) Полной ионизации уксусной кислоты в этой реакции не происходит: когда примерно 1% ее молекул диссоциирует на ионы, скорость соединения последних с образованием исходных молекул становится равной скорости диссоциации и концентрация частиц в растворе перестает меняться. Устанавливается т.н. динамическое равновесие.
Положение равновесия можно изменить (сдвинуть), добавляя или удаляя любое из веществ, участвующих в реакции. При этом равновесие сдвигается таким образом, чтобы эффект изменения концентрации был минимальным (принцип Ле Шателье). Таким образом, добавление воды вызывает дополнительную ионизацию уксусной кислоты (поскольку при ионизации некоторое количество воды связывается в H3O+), а добавление ацетат-иона (СН3СОО–) дает обратный эффект. Каждая равновесная реакция характеризуется т.н. константой равновесия – величиной, равной отношению произведения концентраций продуктов к произведению концентраций исходных реагентов; при этом каждая из концентраций берется в степени, равной числу молекул данного типа, участвующих в реакции. Константа равновесия, как правило, не зависит от концентрации, но изменяется с температурой.
Кинетика
Скорости химических реакций сильно различаются. Например, смесь водорода и кислорода после того, как ее подожгут, буквально взрывается, а превращение алмаза в химически более устойчивую кристаллическую форму углерода, графит, происходит так медленно, что не завершается и за миллиарды лет.
Скорость химических реакций определяется их механизмом. Многие реакции в действительности гораздо сложнее, чем это кажется из их суммарного уравнения. Так, оказалось, что разложение озона с образованием кислорода протекает в два этапа. На первом этапе диссоциирует одна молекула озона, при этом быстро достигается равновесие:
Второй этап гораздо более медленный, он и определяет скорость реакции:
O + O3 → 2O2
Сложение этих двух уравнений приводит к суммарному уравнению
2O3 (г.) → 3O2(г.)
Не исключено, что впоследствии будут предложены другие механизмы, удовлетворяющие экспериментальным данным о скорости этой реакции.
Наименьшая энергия, которой должны обладать взаимодействующие частицы для того, чтобы между ними началась химическая реакция, называется энергией активации. Как правило, чем она ниже, тем быстрее протекает реакция. Для протекания реакции большое значение имеет также энтропийный фактор.
Типы реакций
Реакции можно классифицировать, используя несколько схем, и каждая из них по-своему удобна. Здесь реакции разделены на три типа: ионные, в ходе которых ионы удаляются из зоны реакции путем образования нерастворимого, газообразного или ковалентно связанного продукта; окислительно-восстановительные, в которых происходит перемещение электронов; реакции (в том числе реакции между кислотой Льюиса и основанием Льюиса), сопровождающиеся перераспределением обобществленных электронов.
Ионные реакции
Простые ионные реакции без переноса электронов происходят, когда один из продуктов нерастворим (газ или твердое вещество) или является ковалентно связанным веществом, остающимся в растворе. Ионную реакцию, продукт которой – нерастворимое твердое вещество, можно представить в виде
Сами ионы в ходе реакции не претерпели никаких изменений, но теперь они прочно удерживаются в кристаллической решетке.
Для предсказания хода таких реакций важно знать растворимость участвующих в них веществ. Например, хлорид серебра плохо растворяется в воде, и можно сделать вывод, что реакция
Ag+ (водн.) + Cl- (водн.)  AgCl (тв.)
AgCl (тв.)
хотя и обратима, но равновесие сильно сдвинуто вправо. (Эту реакцию используют для обнаружения ионов хлора или серебра в растворе, а также для их количественного определения. См. также ХИМИЯ АНАЛИТИЧЕСКАЯ.) Ионы серебра могут находиться в составе любого из растворимых соединений: в виде нитрата, сульфата, ацетата и т.д.; ионы хлора могут быть компонентами таких солей, как соли натрия, калия, бария или алюминия. Таким образом, приведенное выше уравнение можно рассматривать как обобщенное представление реакции обменного разложения, когда два реагента разлагаются и обмениваются своими составляющими. Например, это могут быть такие реакции:
AgNO3 (водн.) + NaCl (водн.) → NaNO3 (водн.) + AgCl (тв.)
Ag2SO4 (водн.) + 2NH4Cl (водн.) → (NH4)2SO4 (водн.) + 2AgCl (тв.)
При образовании газообразного продукта вещество тоже выводится из зоны реакции. Этот тип ионной реакции можно представить в следующем виде:
В данном случае ионы перестают существовать – из них образуются молекулы. В качестве примера можно привести растворение карбоната в кислом растворе. Вместе с образующимся газообразным диоксидом углерода из реакционной смеси уходят углерод и кислород:
Реакции, в которых образуется ковалентно связанный (недиссоциирующий) продукт, можно представить следующим образом:
К этому типу относятся реакции нейтрализации. Когда соединение, которое диссоциирует с образованием ионов водорода (кислота), взаимодействует с основанием (источником гидроксильных ионов), образуется вода. В молекуле воды все атомы соединены ковалентными связями, поэтому реакция идет практически до конца (ее константа равновесия равна 10–14). Реакцию нейтрализации можно записать в виде
Приведем примеры реакций нейтрализации с участием сильной (HCl) и слабой (CH3COOH) кислот:
HCl (водн.) + NaOH (водн) → NaCl (водн.) + H2O (ж.)
CH3COOH (водн.) + KOH (водн.) → CH3COOK (водн.) + H2O (ж.)
Сильные кислоты практически полностью диссоциируют в воде, высвобождая ионы водорода, слабые диссоциируют незначительно. Плохо диссоциируют и слабые основания.
Ниже перечислены наиболее распространенные кислоты и основания. Отметим, что некоторые соединения обладают как кислотными, так и основными свойствами. Их называют амфотерными.
|
Сильные кислоты |
Слабые кислоты |
Сильные основания |
Слабые основания |
| HI | HSO4– | NaOH | NH3 |
| HCl | HPO42– | KOH | CH3COO– |
| HBr | H2S | Ba(OH)2 | HPO42– |
| HNO3 | CH3COOH | Ca(OH)2 | CO32– |
| H3PO4 | HClO | AgOH | HCO3– |
| H2SO4 | H2CO3 | S2– | HS– |
| HClO4 | HCO3– | PO43– |
Слабые основания, представленные в таблице, не содержат ионов ОН–. Эти ионы образуются при взаимодействии с водой:
CO32– (водн.) + H2O (ж.) → HCO3– (водн.) + OH– (водн.)
Поэтому раствор карбоната щелочной.
Более общее определение кислот и оснований, которое используется и в случае неводных систем, например газов, было дано американским физикохимиком Г.Льюисом. Взаимодействие между льюисовыми кислотами и основаниями – это реакция между донором электронной пары, за счет которой образуется ковалентная связь (основание Льюиса), и акцептором этой пары (кислота Льюиса). В качестве примера можно привести следующие реакции:
H3N: (г.) + BF3 (г.) → H3N+ : B- F3 (г.)
H2O (ж.) + AgCl (тв.) + 2 : NH3 (г.) → [H3N : Ag : NH3]+ Cl- (водн.)
Аg(NH3)2 Cl
Окислительно-восстановительные реакции
Эти реакции сопровождаются переносом электронов между ионами, атомами или соединениями и могут быть представлены следующим образом:
О соединении, которое отдает электроны, говорят, что оно окисляется; его называют восстановителем. Соединение, принимающее электроны, восстанавливается и является окислителем. Наиболее распространенные примеры окисления – реакции с участием элементного кислорода, например ржавление железа или горение любых горючих веществ. Уравнение горения магния имеет вид
Примером окислительно-восстановительной реакции, протекающей без участия кислорода, является взаимодействие металлического натрия с газообразным хлором:
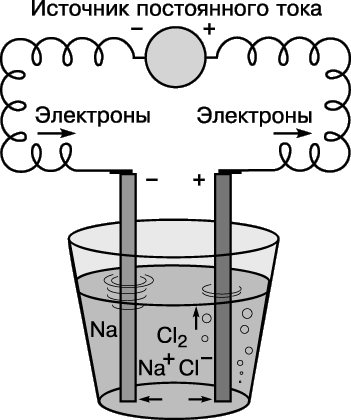
Этот способ написания уравнения показывает, что оба элемента по окончании реакции приобретают электронную конфигурацию инертного газа (на их внешних электронных оболочках – по 8 электронов). Направление этой реакции можно изменить на противоположное, приложив электрическое напряжение. Если пару электродов (графитовых стержней) погрузить в расплав хлорида натрия и соединить с источником постоянного тока, на отрицательном электроде произойдет реакция Na+ + e– → Na, а на положительном – 2Cl– → Cl2 + 2e– (здесь е– – электрон). Этот процесс называют электролизом. (Устройство для проведения электролиза – электролитическая ячейка.)
Процесс электролиза применяется для перезарядки свинцовых аккумуляторов и нанесения металлических покрытий (например, серебрение).
См. также ЭЛЕКТРОХИМИЯ; МЕТАЛЛОПОКРЫТИЯ.
Окислительно-восстановительные реакции удобно представлять в виде суммы двух полуреакций, аналогичных тем, которые использовались для иллюстрации перемещения электронов между ионами натрия и хлора. Каждая полуреакция характеризуется электродным окислительно-восстановительным потенциалом, величиной которого определяется легкость передачи электронов. Этот потенциал зависит не только от природы соединения, но также от его концентрации, концентрации других веществ, вступающих в реакцию, и от температуры. Численные значения этих потенциалов обычно приводятся для конкретных условий: для растворенных веществ это эффективная концентрация 1 М; для газов – давление 1 атм (или парциальное давление 1 атм для каждого из газов, участвующих в реакции); для плохо растворимых твердых веществ и жидкостей – сами чистые твердые вещества и жидкости. В табл. 2 приведены значения стандартных потенциалов для некоторых распространенных полуреакций, представленных в виде реакций восстановления. Отметим, что для каждой полуреакции восстановленная форма вещества записывается в правой части уравнения, а окисленная – в левой. Паре ион водорода/газообразный водород приписан нулевой потенциал, потенциалы всех остальных пар измеряются по отношению к нему. Таким образом, пара с положительным потенциалом содержит лучший, чем ион водорода, окислитель, а пара, имеющая отрицательный потенциал, – лучший, чем газообразный водород, восстановитель. Величина окислительной или восстановительной способности вещества прямо пропорциональна стандартному потенциалу.
|
Таблица 2. СТАНДАРТНЫЕ ПОТЕНЦИАЛЫ |
|
|
Полуреакция |
Потенциал, В |
| F2 + 2e– → 2F– |
2,87 |
| H2O2 + 2H+ + 2e– → 2H2O |
1,78 |
| Cl2 + 2e– → 2Cl– |
1,36 |
| Cr2O72– + 14H+ + 6e– → 2Cr3+ + 7H2O |
1,33 |
| MnO2 + 4H+ + 2e– → Mn2 + + 2H2O |
1,23 |
| Ag+ + e– → Ag |
0,80 |
| Cu+ + e– → Cu |
0,52 |
| Cu2+ + 2e– → Cu |
0,34 |
| Sn4+ + 2e– → Sn2+ |
0,15 |
| 2H+ +2e– → H2 |
0,00 |
| Sn2+ +2e– → Sn |
–0,14 |
| Fe2+ + 2e– → Fe |
–0,44 |
| Zn2+ + 2e– → Zn |
–0,76 |
| Mg2+ + 2e– → Mg |
–2,37 |
| Na+ + e– → Na |
–2,71 |
| Li+ + e– → Li |
–3,05 |
Таблицу 2 можно использовать для предсказания хода многих реакций. Нужно только помнить, что если полуреакцию записывают в противоположном направлении, чем это сделано в таблице, то ее потенциал следует брать с противоположным знаком. Обычно реакции идут до конца, если сумма потенциалов двух полуреакций (потенциал ячейки) положительна и превышает примерно 0,1 В. Если потенциал ячейки находится в интервале от +0,1 до –0,1 В, то между реагирующими веществами устанавливается равновесие, причем в реакционном объеме все они присутствуют в заметных количествах. Если же потенциал ячейки ниже –0,1 В, то реакция, по существу, не идет. Однако если полоску цинка погрузить в раствор, содержащий ион меди, будет протекать реакция
Поскольку потенциал представляет собой большую положительную величину, реакция идет до конца. Если же полоску меди поместить в раствор, содержащий ион цинка, то реакция Cu + Zn2+ → Cu2+ + Zn не произойдет из-за высокого отрицательного потенциала ячейки (–1,10 В).
Если смешать растворы, содержащие бихромат-ион и ион марганца(II), то между реагентами и продуктами установится равновесие, при этом оба иона и продукты реакции – оксид марганца(II) и ион хрома(III) – будут присутствовать в достаточно большой концентрации, поскольку потенциал этой реакции при стандартных условиях составляет лишь 0,1 В.
3Mn2+ + 6H2O = 3MnO2 + 12H+ + 6e- – (+1,23) B
6e- + 14H+ + Cr2O72- = 7H2O + 2Cr3+ + 1,33 B
3Mn2+ + Cr2O72- + 2H+ → 3MnO2 + 2Cr3+ + H2O + 0,10 B
Отметим, что правая и левая части уравнения первой полуреакции умножены на три, чтобы получить число электронов, необходимое для второй полуреакции. Величина потенциала от этого не изменяется. В обеих частях суммарного уравнения должно быть одинаково не только число атомов каждого типа, но и суммарный электрический заряд (в данном случае он равен +6).
В отличие от электролитической ячейки, во внешнюю цепь которой включен источник тока, гальванический элемент сам вырабатывает электричество. Гальваническими элементами являются, например, свинцовый автомобильный аккумулятор и батарейка для карманного фонарика. Напряжение, которое дает элемент, определяется потенциалами протекающих в нем полуреакций.
Реакции с перераспределением обобществленных электронов.
Приведем несколько примеров таких реакций:
Более подробное обсуждение реакций с участием неорганических и органических соединений можно найти в статье ХИМИЯ ОРГАНИЧЕСКАЯ.
РАЗДЕЛЫ ХИМИИ
Химию довольно произвольно делят на несколько разделов, которые нельзя четко отграничить ни от других областей химии, ни от других наук (физики, геологии, биологии).
Неорганическая химия занимается изучением химической природы элементов и их соединений, за исключением большинства соединений углерода.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ; ВОДОРОД; АЗОТ; КИСЛОРОД; ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ.
Органическая химия изучает соединения, состоящие в основном из углерода и водорода. Поскольку атомы углерода могут соединяться друг с другом с образованием колец и длинных цепочек, как линейных, так и разветвленных, таких соединений существует сотни тысяч. Из органических соединений состоят уголь и нефть, они составляют основу живых организмов. Химики-органики научились получать из угля, нефти, растительных материалов синтетические волокна, пестициды, красители, лекарства, пластики и множество других полезных вещей.
См. также УГЛЕРОД; ХИМИЯ ОРГАНИЧЕСКАЯ; КРАСИТЕЛИ И КРАШЕНИЕ; ТЕКСТИЛЬ; ПЛАСТМАССЫ; КАУЧУК.
Радиохимия – это наука о химическом воздействии высокоэнергетического излучения на вещества; она занимается также изучением поведения радиоактивных изотопов.
См. также ИЗОТОПЫ; РАДИОАКТИВНОСТЬ.
Физическая химия использует физические методы для изучения химических систем. Большое место в ней занимают вопросы энергетики химических процессов; соответствующий раздел химии называется химической термодинамикой. К важнейшим направлениям относятся химическая кинетика и строение молекул. Электрохимия изучает химические процессы, протекающие под действием электрического тока, а также способы получения электричества химическими методами. Среди других направлений следует отметить коллоидную химию (она занимается исследованием поведения дисперсных систем), химию поверхностных явлений, статистическую механику.
См. также ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА; ХИМИЯ КОЛЛОИДНАЯ; ХИМИЯ ФИЗИЧЕСКАЯ; ХИМИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ; ЭЛЕКТРОХИМИЯ; ФОТОХИМИЯ.
Аналитическая химия – старейшая область химии. Она занимается разложением сложных веществ на более простые, анализом самих веществ и их составляющих. Сегодня в ней широко используются сложное физическое оборудование и компьютеры, позволяющие автоматизировать рутинные процессы, сбор и обработку данных. См. также ХИМИЯ АНАЛИТИЧЕСКАЯ.
Биохимия изучает сложнейшие химические процессы, протекающие в живых организмах. Биохимик должен детально знать органическую химию, владеть многими химическими и физическими методами анализа. К биохимии примыкают биофизика и молекулярная биология.
См. также БИОХИМИЯ; БИОФИЗИКА; МОЛЕКУЛЯРНАЯ БИОЛОГИЯ.
Геохимия занимается исследованием химических процессов, протекающих в земной коре. Она изучает образование минералов, метаморфоз скальных пород, образование нефти, пересекается с органической химией и биохимией, а также физикой и физической химией.
См. также ГЕОЛОГИЯ; МИНЕРАЛЫ И МИНЕРАЛОГИЯ; НЕФТЬ И ГАЗ.
Реми Р. Курс неорганической химии, тт. 1–2. М., 1972
Полинг Л., Полинг П. Химия. М., 1978
Дикерсон Р., Грей Г., Холт Дж. Основные законы химии, тт. 1–2. М., 1982
Салем Л. Электроны в химических реакциях. М., 1985
Годмен А. Иллюстрированный химический словарь. М., 1988
Эткинс П. Молекулы. М., 1991
Ответь на вопросы викторины «Неизвестные подробности»