ТРЕХЦЕНТРОВЫЕ СВЯЗИ
ТРЕХЦЕНТРОВЫЕ СВЯЗИ – особый тип химических связей, при котором три атома (три центра) связаны двумя электронами.
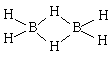
У атома бора всего три валентных электрона, поэтому в молекуле простейшего гидрида бора BH3 у атома бора не остается электронов для образования дополнительных связей. В результате долгое время было неясно, каким образом в бороводородах, например, в диборане В2Н6, напоминающем этан, или тетраборане В4Н10 – аналоге бутана, атомы бора соединены непосредственно друг с другом.
Классические представления, по которым пара электронов связывает два атома, в данном случае оказались неприменимы. В 1950-е было сформулировано понятие трехцентровых связей.
Строение трехцентровых связей
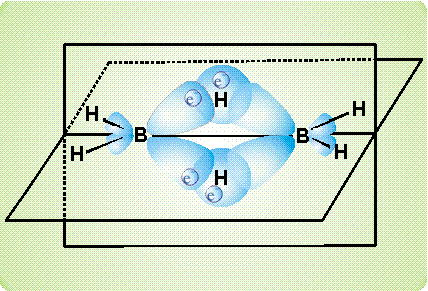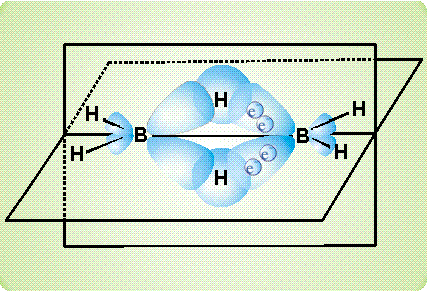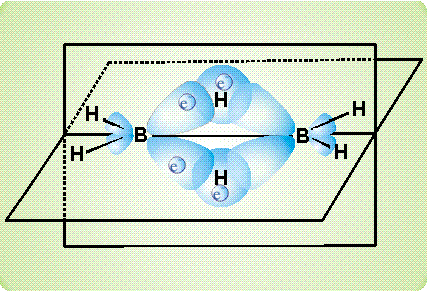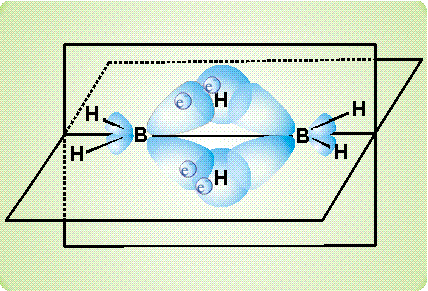
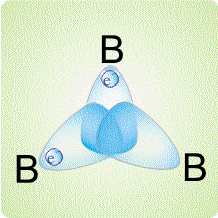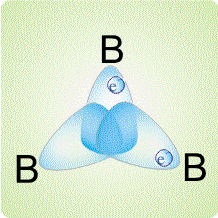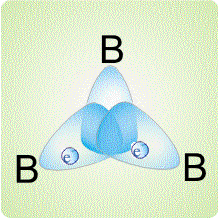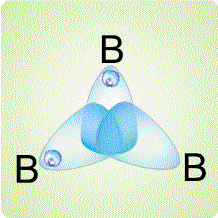
рассмотрено ниже на примере диборана В2Н6. Согласно современным представлениям, атомы бора в этом соединении непосредственно не связаны друг с другом. Они соединяются с помощью атомов водорода. На приведенном рисунке показано, как сферическая s-орбиталь водорода перекрывается одновременно двумя вытянутыми p-орбиталями двух атомов бора (орбиталь – область наиболее вероятного расположения электрона в пространстве, иначе говоря, электронное облако определенной формы). Образуется две таких связи (над и под мысленной плоскостью, в которой расположены фрагменты ВН2).
Таким образом, в связь В-Н, лежащую над плоскостью и образованную традиционной парой электронов, вовлекается еще один атом бора (расположенный справа), который не поставляет электрон для образования связи. Он участвует своей четвертой, вакантной орбиталью, не занятой электроном. В результате, два атома бора и один атом водорода – три центра – оказываются связанными двумя электронами, возникает так называемая трехцентровая двухэлектронная связь.
Для изображения трехцентровых связей используют обычные символы валентных связей, при этом диборан В2Н6 представляют следующим образом:
Внешне водород выглядит как бы двухвалентным, что и указывает на присутствие трехцентровй связи. Атомы водорода, участвующие в такой связи, называют мостиковыми в отличие от обычных концевых Н-атомов.
Трехцентровые связи могут возникать не только в треугольнике из двух атомов бора и одного атома водорода, но и между тремя атомами бора:
Такой тип связей реализуется, например, в карборане.
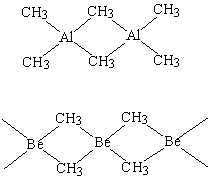
В образовании трехцентровых связей могут участвовать также атомы углерода совместно с атомами бора, алюминия или бериллия. В показанных ниже триметилалюминии и диметилбериллии роль мостиковых групп исполняют метильные группы:
В результате триметилалюминий становится димером (Me3Al)2, а диметилбериллий приобретает цепочечную структуру. Общий принцип остается тем же – три атома (например, Al-C-Al) соединены с помощью двух электронов, по одному электрону поставляют два атома (Al и C), третий атом (Al) участвует вакантной орбиталью.
Михаил Левицкий
Охлобыстин О.Ю. Третья химия, «Наука», Москва, 1965
Граймс Р. Карбораны (пер. с англ.), «Мир», Москва, 1974
Ответь на вопросы викторины «Неизвестные подробности»