ПРОСТЫЕ ЭФИРЫ
ПРОСТЫЕ ЭФИРЫ – класс органических соединений (см. ХИМИЯ ОРГАНИЧЕСКАЯ), содержащих фрагмент R–O–R', в котором две органические группы соединены атомом кислорода. Прилагательное «простые» в названии эфиров помогает отличить их от другого класса соединений, именуемого сложными эфирами.
Номенклатура простых эфиров.
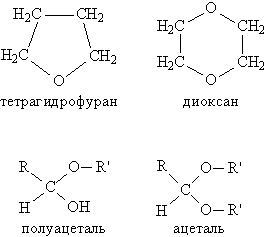
Если группы R и R' в простом эфире одинаковы, то его называют симметричным, если разные – несимметричным. В название эфира включают названия органических групп, упоминая их в алфавитном порядке, и добавляют слово эфир, например, C2H5OC3H7 – пропилэтиловый эфир. Для симметричных эфиров перед названием органической группы вводят приставку «ди», например, C2H5OC2H5 – диэтиловый эфир. Для многих эфиров часто используют тривиальные (упрощенные) названия, сложившиеся исторически. К простым эфирам иногда относят соединения, которые содержат эфирный фрагмент С–О–С в составе циклической молекулы (рис. 1), одновременно их причисляют к другому классу соединений – гетероциклическим соединениям. Есть также соединения (см. АЛЬДЕГИДЫ И КЕТОНЫ), в состав которых входит фрагмент С–О–С, но к классу эфиров их не относят, это полуацетали – соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR, а также ацетали – соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR)2 (рис. 1). Наличие у одного атома углерода сразу двух химически связанных атомов О делает эти соединения непохожими по химическим свойствам на простые эфиры.
Рис. 1. ПРОСТЫЕ ЭФИРЫ, содержащие эфирный фрагмент в составе циклической молекулы (чаще такие соединения относят к гетероциклическим), а также полуацетали и ацетали, содержащие эфирный фрагмент, но не относящиеся к классу простых эфиров.
Химические свойства простых эфиров.
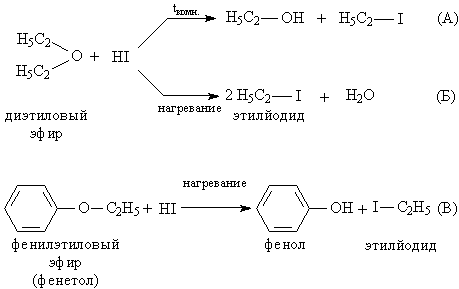
Простые эфиры представляют собой бесцветные жидкости с характерным (так называемым эфирным) запахом, практически не смешиваются с водой и неограниченно смешиваются с большинством органических растворителей. В сравнении со спиртами и альдегидами простые эфиры химически менее активны, например, они устойчивы к действию щелочей и щелочных металлов (металлический Na применяют даже для удаления следов воды из эфиров). В отличие от щелочей, кислоты расщепляют эфирный фрагмент, для этого чаще применяют галоидоводороды, особенно эффективен HI. При комнатной температуре образуется и спирт, и йодистый алкил (рис. 2А), а при нагревании – йодистый алкил и вода (рис.2А), т.е. реакция протекает более глубоко. Простые эфиры, содержащие ароматические циклы, более устойчивы к расщеплению, для них возможна только стадия, аналогичная А, образуется фенол, а йод к ароматическому ядру не присоединяется (рис. 2В).
Рис. 2. РАСЩЕПЛЕНИЕ ЭФИРНОГО ФРАГМЕНТА при действии HI
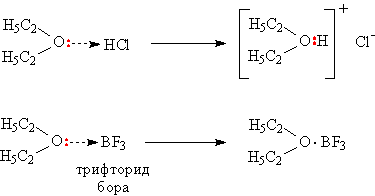
Атом кислорода в эфирном фрагменте содержит свободную электронную пару С–Ö–C, благодаря этому эфиры оказываются способными присоединять различные нейтральные молекулы, склонные к образованию донорно-акцепторных связей, атом кислорода дает для образования связи электронную пару (донор), роль акцептора, принимающего эту пару, играет присоединяющаяся молекула или ион (см. АМИНЫ). В результате возникают комплексные соединения (рис. 3).
Рис. 3. ОБРАЗОВАНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ С УЧАСТИЕМ ПРОСТЫХ ЭФИРОВ
В присутствии кислорода воздуха на свету эфиры частично окисляются с образованием перекисных соединений R–O–O–R', которые способны взрываться даже при слабом нагреве, поэтому, приступая к перегонке эфира, его предварительно обрабатывают восстановителями, разрушающими перекиси, часто вполне достаточно хранить эфир над металлическим Na.
Получение простых эфиров.
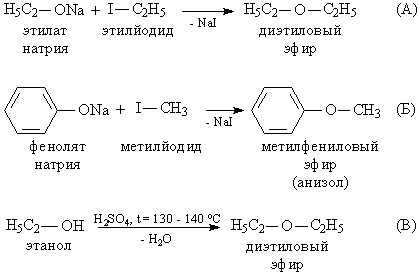
Наиболее удобный способ – взаимодействие алкоголятов щелочных металлов R'ONa с алкилгалогенидами RHal, таким методом можно получать как симметричные (рис. 4А), так и несимметричные простые эфиры (рис. 4Б). В промышленности симметричные простые эфиры получают дегидратацией (отщеплением воды) спиртов с помощью серной кислоты (рис. 4В), этот метод позволяет получать эфиры, у которых в органической группе R не более 5 атомов С.
Рис. 4. ПОЛУЧЕНИЕ ПРОСТЫХ ЭФИРОВ
Применение простых эфиров
определяется, в основном, тем, что они очень хорошо растворяют многие жиры, смолы и лаки. Наиболее широко используют ДИЭТИЛОВЫЙ ЭФИР (С2Н5)2О, техническое название – «серный эфир», поскольку его получают в присутствии серной кислоты (рис. 4В). Помимо применения в качестве растворителя, а также в роли реакционной среды при проведении различных органических синтезов его используют и для экстрагирования (извлечения) некоторых органических веществ, например, спиртов, из водных растворов, поскольку сам эфир очень мало растворим в воде. В медицине серный эфир применяют для наркоза.
Диизопропиловый эфир (СН3)2СНОСН(СН3)2 используют как растворитель и как добавку к моторному топливу для повышения октанового числа.
Анизол С6Н5ОСН3 (рис. 4) и ФЕНЕТОЛ С6Н5ОС2Н5 (рис. 3) используют в качестве промежуточных продуктов при получении красителей, лекарств и душистых веществ.
Дифениловый эфир (дифенилоксид) (С6Н5)2О из-за высокой температуры кипения (259,3° С) и химической устойчивости применяют как теплоноситель. Чтобы при остывании до комнатной температуры он не переходил в твердое состояние (его т. пл. 28–29° С), в него добавляют дифенил (С6Н5)2. Такая смесь, называемая в технике даутермом, может работать как теплоноситель в широком диапазоне температур.
Диоксан, циклический эфир (СН2СН2О)2 (рис.), по химическим свойствам близок обычным простым эфирам, но в отличие от них неограниченно смешивается с водой и большинством органических растворителей. Растворяет жиры, воски, масла, эфиры, целлюлозы, его широко применяют и как реакционную среду при проведении различных органических синтезов.
Михаил Левицкий
Шабаров Ю.С. Органическая химия. М., Химия, 1994
Ответь на вопросы викторины «Неизвестные подробности»