КРАУН-ЭФИРЫ
КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков –СН2–СН2– и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название (англ. crown – корона).
Номенклатура краун-эфиров.
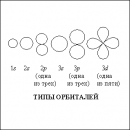
Рис. 1. СОСТАВЛЕНИЕ НАЗВАНИЙ ДЛЯ КРАУН-ЭФИРОВ
Свойства краун-эфиров.
Формально все краун-эфиры можно отнести к классу гетероциклических соединений, однако необычные свойства таких соединений позволили выделить их в самостоятельный класс, в связи с чем для составления названий были предложены специальные правила. Название содержит слово «краун», цифра перед этим словом обозначает общее число атомов в цикле, а цифра в конце названия указывает на количество гетероатомов O, N и S (рис.1). В названии не указывают наличие в цикле атомов О (это подразумевается), но если в цикле есть иные гетероатомы (кроме кислорода), например, азот или сера, то их количество указывают, добавляя к названию приставки ди- или три-, а положение в цикле – с помощью числовых индексов, предварительно нумеруются все атомы в цикле.
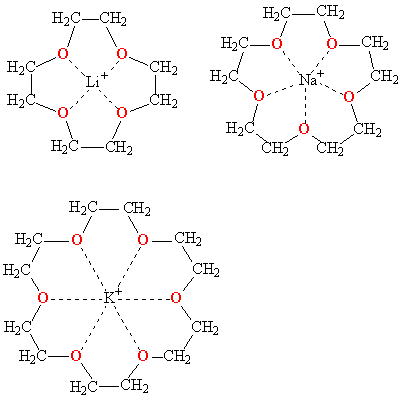
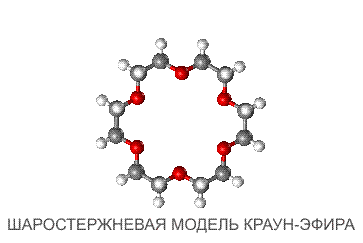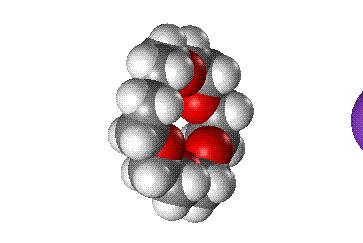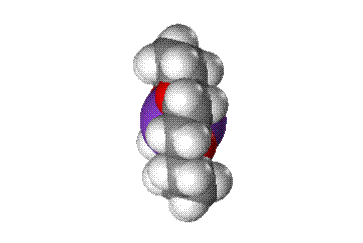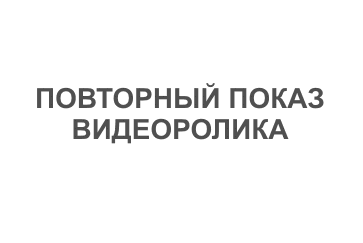
Краун-эфиры содержат фрагмент С–О–С, характерный для простых эфиров, а также могут включать фрагменты амина C–NH–C, или тиоэфира C–S–C (см. СЕРАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ). Характерное свойство этих классов соединений – образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы. Это свойство многократно усилено в краун-эфирах из-за большого числа гетероатомов в цикле, к тому же неподеленные электронные пары ориентированы внутрь цикла. В результате ионы щелочных и щелочноземельных металлов входят внутрь цикла, образуя прочные комплексы. Меняя величину цикла и, соответственно, размер внутренней полости, можно точно настроить краун-эфир на удерживание катиона определенного размера, например, 12-краун-4 (рис. 1) наиболее прочно захватывает катион лития, 15-краун-5 соответствует по размеру катиону натрия, а 18-краун-6 «подходит по размеру» катиону калия (рис. 2).
Рис. 2. КОМПЛЕКСЫ КРАУН-ЭФИРОВ с катионами щелочных металлов (пунктирными линиями показаны координационные связи)
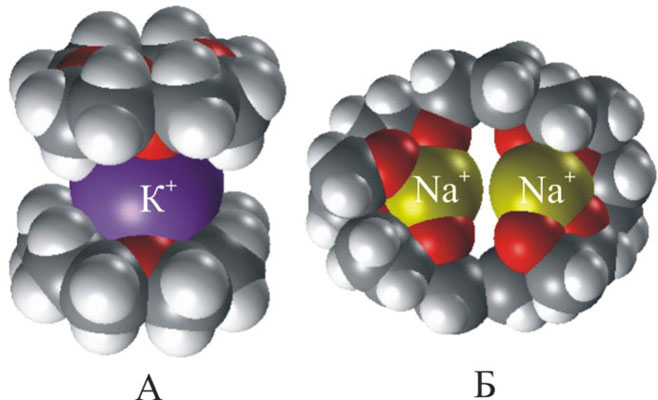
Более наглядно взаимосоответствие внутренней полости цикла и размера катиона можно показать с помощью объемных моделей (рис. 3).
У краун-эфиров склонность к «захвату» катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживаеся. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда (рис. 4А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. 4Б).
Подобные комплексы менее устойчивы, чем те, у которых размер катиона точно соответствует величине внутренней полости.
Краун-эфиры открыли новые горизонты в синтетической органической химии, с их помощью оказалось возможным вводить в растворенном виде (т.е. гомогенно), неорганические реагенты в органическую среду. Например, широко применяемый окислитель перманганат калия KMnO4 практически нерастворим в органических растворителях, но в присутствии 18-краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы MnO4–, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
Получение краун-эфиров.
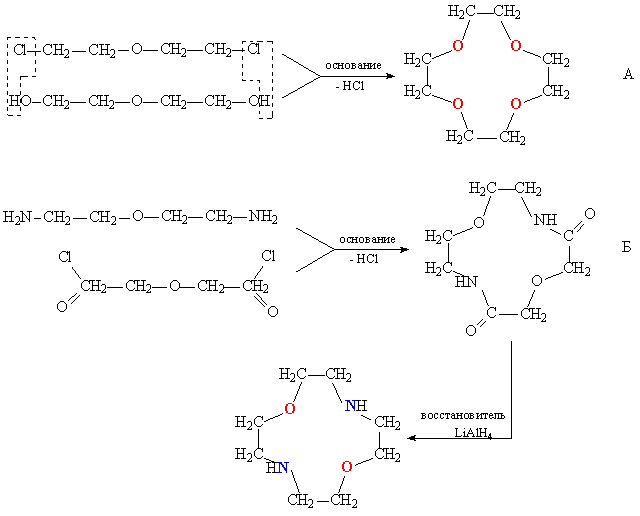
При конденсации дихлоралкилов, содержащих в цепи простые эфирны группировки С–О–С, с полиэтиленгликолями протекает циклизация, приводящая к образованию краун-эфира (рис. 5А). В зависимости от длины цепочки исходных соединений получают краун-эфиры с различной величиной цикла. Азотсодержащие краун-эфиры получают конденсацией диаминов, содержащих эфирные группировки, с хлорангидридами дикарбоновых кислот. В результате получаются циклические амиды, которые затем восстанавливают, при этом карбонильные группы С=О превращаются в метиленовые СН2 (рис. 5Б). Серосодержащие краун-эфиры получают по схеме А (рис. 5), при этом исходные соединения содержат тиоэфирные группировки С–S–С.
Применение краун-эфиров определяется, прежде всего, их избирательной способностью захватывать катионы определенного размера. Наибольшее распространение получили краун-эфиры, содержащие только гетероатомы О. Их применяют в технологических процессах, связанных с выделением и очисткой солей щелочных и щелочноземельных металлов, в аналитических исследованиях и работах, связанных с синтезом, когда нужно перевести неорганические соединения из водной фазы в органическую среду.
Краун-эфиры обладают противомикробной и противопаразитарной активностью, кроме того, из организма с их помощью выводятся ионы токсичных тяжелых металлов, а также радиоактивных изотопов цезия и стронция.
В радиохимии краун-эфиры помогают решать проблему переработки отходов ядерных производств. Первый этап – удаление с помощью краун-эфиров из переработанного ядерного горючего наиболее активных изотопов (стронций-90, цезий-137, технеций-99), на этой стадии предпочтительны S-содержащие краун-эфиры, поскольку они обладают повышенной радиационной стойкостью. Извлеченные изотопы используются затем в установках радиодиагностики, заменяющих рентгеновские аппараты, а также при создании долговременных источников тока для метеостанций, метеозондов и космических аппаратов. Следующий этап переработки ядерного топлива – извлечение с помощью краун-эфиров (специально подобранного состава) неизрасходованных урана и плутония, после чего объем подлежащих утилизации отходов становятся заметно меньше и к тому же отходы обладают слабой радиоактивностью.
На основе краун-эфиров созданы электропроводящие материалы нового типа (см. ЭЛЕКТРИДЫ).
За развитие химии макрогетероциклических соединений американский химик Ч.Педерсен, фактически создавший новый класс соединений – краун-эфиры, в 1987 (совместно Д.Крамом и Ж.Леном) был удостоен Нобелевской премии.
Михаил Левицкий
Хараока М. Краун-соединения. М., Мир, 1986
Давыдова С.Л. Удивительные макроциклы. Л., 1989
Ответь на вопросы викторины «Неизвестные подробности»