ФИЗИКА ТВЕРДОГО ТЕЛА
ФИЗИКА ТВЕРДОГО ТЕЛА, раздел физики, изучающий структуру и свойства твердых тел. Научные данные о микроструктуре твердых веществ и о физических и химических свойствах составляющих их атомов необходимы для разработки новых материалов и технических устройств.
Физика твердого тела – один из тех столпов, на которых покоится современное технологическое общество. В сущности, вся армия инженеров работает над наилучшим использованием твердых материалов при проектировании и изготовлении самых разнообразных инструментов, станков, механических и электронных компонентов, необходимых в таких областях, как связь, транспорт, компьютерная техника, а также фундаментальные исследования.
Исследователя, работающего в области физики твердого тела, интересуют такие материалы, как металлы и сплавы, полупроводники, диэлектрики и магнитные материалы. Многие из них относятся к кристаллическим веществам: их атомы расположены так, что образуют правильную трехмерную решетку – периодическую структуру. Нарушения идеальной периодичности могут быть обусловлены химическими примесями, незаполненными (вакантными) атомными узлами, атомами внедрения (в промежутках между узлами), а также дислокациями. Во многих случаях подобными нарушениями или отклонениями от строгой периодичности существенным образом определяются физические свойства кристаллических твердых тел. Управляя концентрацией подобных дефектов или целенаправленно создавая их, можно получать «наперед заданные» свойства твердых тел. Такая технология играет первостепенную роль, например, в области полупроводниковой микроэлектроники. Другой класс материалов, представляющий интерес для физики твердого тела, – это стеклообразные, или аморфные, материалы. Атомы в таких материалах располагаются в общем так же, как и в жидкостях, т.е. они упорядочены лишь в пределах нескольких межатомных расстояний от каждого атома, принятого за центральный. Иначе говоря, для стекол характерен ближний порядок в расположении атомов, а не дальний, как в кристаллической структуре.
См. также КРИСТАЛЛЫ; ПОЛУПРОВОДНИКОВЫЕ ЭЛЕКТРОННЫЕ ПРИБОРЫ.
СВОЙСТВА ТВЕРДЫХ ТЕЛ
К физическим свойствам твердых тел относятся механические, тепловые, электрические, магнитные и оптические свойства. Их изучают, наблюдая, как ведет себя образец при изменении температуры, давления или объема, в условиях механических напряжений, электрических и магнитных полей, температурных градиентов, а также под воздействием различных излучений – света, рентгеновских лучей, пучков электронов, нейтронов и т.п.
Значительная часть лабораторного оборудования, необходимая для изучения этих свойств, сама состоит из твердотельных устройств. Химические свойства твердых тел особенно существенны при изучении поверхностных явлений.
См. также ХИМИЯ; ХИМИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ.
Структура.
Твердое тело состоит из атомов. Само его существование указывает на наличие интенсивных сил притяжения, связывающих атомы воедино, и сил отталкивания, без которых между атомами не было бы промежутков. В результате таких взаимодействий атомы твердого тела частично теряют свои индивидуальные свойства, и именно этим объясняются новые, коллективные свойства системы атомов, которая называется твердым телом.
Какова природа этих сил? Свободный атом состоит из положительно заряженного ядра и некоторого числа отрицательно заряженных электронов (масса которых значительно меньше массы ядра). Хорошо известные кулоновские (электрические) силы, действующие между заряженными частицами, создают притяжение между ядром и электронами, а также взаимное отталкивание между электронами. Поэтому твердое тело можно рассматривать как состоящее из системы взаимно отталкивающихся ядер и системы взаимно отталкивающихся электронов, причем обе эти системы притягиваются друг к другу. Физические свойства такого объекта определяются двумя фундаментальными физическими теориями – квантовой механикой и статистической механикой. Хотя характер взаимодействий между частицами известен, их необычайно большое число (~1022 ядер и еще больше электронов в 1 см3) не позволяет дать точное теоретическое описание твердого тела.
См. также АТОМА СТРОЕНИЕ; ЭЛЕКТРИЧЕСТВО И МАГНЕТИЗМ; КВАНТОВАЯ МЕХАНИКА; СТАТИСТИЧЕСКАЯ МЕХАНИКА.
Использование моделей.
В физике твердого тела обычно принимают упрощенные модели твердого тела и затем проводят вычисления их физических свойств. Модели должны быть достаточно простыми, для того чтобы было возможно их теоретическое описание, и в то же время достаточно сложными, для того чтобы они обладали исследуемыми свойствами. Например, для объяснения некоторых общих закономерностей электрической проводимости вполне подходит простая модель металла в виде системы положительных ионов, погруженных в газ подвижных электронов. Но оказалось крайне трудно построить подходящую физическую модель, которая позволила хотя бы качественно объяснить явление сверхпроводимости, открытое в 1911 голландским физиком Камерлинг-Оннесом.
Сверхпроводимость.
Известно, что при низких температурах у многих металлов и сплавов необычайно повышается способность проводить электричество. (Электрический ток представляет собой упорядоченное движение электронов.)
В 1956 американский физик Л.Купер пришел к выводу, что при определенных условиях электроны проводимости в металле могут образовывать слабо связанные пары. Именно эти куперовские пары лежат в основе знаменитой теории сверхпроводимости Бардина – Купера – Шриффера (БКШ), построенной в 1957; в 1972 эти три американских физика были удостоены Нобелевской премии.
В сверхпроводящем состоянии вещество не оказывает сопротивления электрическому току. Поэтому сверхпроводящие вещества представляют большой интерес для энергетиков, которые рассчитывают с их помощью, например, передавать электрический ток на значительные расстояния без тепловых и иных потерь. Однако выше определенной (так называемой критической) температуры сверхпроводимость исчезает, и у металла вновь появляется электрическое сопротивление. В некоторых условиях сверхпроводимость разрушается также магнитным полем. Электрический ток, проходящий через сверхпроводник, создает на поверхности собственное магнитное поле, а потому существует верхний предел плотности сверхпроводящего тока, выше которого сверхпроводимость также разрушается. Все это, и в первую очередь низкие критические температуры, ограничивает возможности широкомасштабного применения сверхпроводников. Сверхпроводники необходимо непрерывно охлаждать жидким водородом, а еще лучше жидким гелием. Тем не менее, сверхпроводящие обмотки (например, из сплавов титана с ниобием) уже нашли широкое применение в электромагнитах. Продолжается поиск новых материалов (в том числе органических кристаллов и полимеров) с более высокими критическими температурами, а также возможностей дальнейшего применения сверхпроводников. Специалисты надеются, что широкомасштабное применение сверхпроводников в электродвигателях и генераторах промышленного производства начнется уже в ближайшие годы. Особенно захватывающие перспективы сулит применение сверхпроводников в рельсовом транспорте. При движении магнита относительно проводника в проводнике индуцируются вихревые токи, которые в свою очередь порождают магнитные поля, отталкивающие движущийся магнит. Снабдив, например, поезд сверхпроводящим магнитом и используя рельс в качестве проводника, можно добиться эффекта магнитного подвешивания (левитации). Такие поезда на магнитной подвеске должны, как считается, иметь ряд преимуществ перед обычными поездами и поездами на воздушной подушке.
См. также СВЕРХПРОВОДИМОСТЬ.
Эффект Джозефсона.
Другое направление развития в области сверхпроводимости было инициировано работой английского физика Б.Джозефсона, который в 1962 предсказал возможность удивительных эффектов, связанных с прохождением (квантовомеханическим туннелированием) куперовских электронных пар от одного сверхпроводника к другому сквозь тонкий слой изолирующего вещества. Эксперименты вскоре подтвердили его предсказания. Одним из интересных свойств такого перехода (называемого джозефсоновским) является то, что ток куперовских пар через него возможен даже в отсутствие разности потенциалов между сверхпроводниками. (Согласно классическим представлениям, электрический ток возникает лишь между точками с разными значениями потенциала.) Однако еще более разительный эффект состоит в том, что постоянная разность потенциалов, приложенная к джозефсоновскому переходу, вызывает возникновение переменного тока через переход. Частота этого тока дается простой формулой n = 2eV/h, где 2e – заряд куперовской электронной пары, V – приложенное напряжение, а h – фундаментальная константа, называемая постоянной Планка.
См. также ПЛАНКА ПОСТОЯННАЯ.
Неудивительно, что за теоретическими предсказаниями Джозефсона последовала волна исследований в физике и технике. Устройства, основанные на эффекте Джозефсона, нашли применение в качестве сверхчувствительных детекторов в самых различных областях от радиоастрономии до биомедицинских приложений. В 1973 Джозефсону была присуждена Нобелевская премия за вклад в физику твердого тела.
См. также СВЕРХПРОВОДИМОСТЬ.
Транзисторы.
Возможно, наибольшее влияние на развитие современной физики твердого тела оказали открытия американских физиков, сделанные в 1949: транзистора с точечными (Дж.Бардин, У.Браттейн) и плоскостными (У.Шокли) переходами. Эти открытия были сделаны в ходе исследования электрических свойств особого класса твердых тел, называемых полупроводниками.
См. также ТРАНЗИСТОР.
Транзистор был первым полупроводниковым устройством, способным выполнять такие функции вакуумного триода (состоящего из анода, катода и сетки), как усиление и модуляция. Транзистор обладал несомненными преимуществами перед электронной лампой, поскольку не нуждался в токе накаливания катода, имел значительно меньшие размеры и массу, а также больший срок службы. Поэтому транзисторы вскоре вытеснили электронные лампы и произвели революцию в электронной промышленности. Второй этап этой революции соответствовал переходу от отдельных транзисторов к интегральным микросхемам. Такая микросхема содержит на поверхности монокристалла кремния (чипа) площадью 1 мм2 многие тысячи схемных компонентов. Электротехнику на микроскопическом и атомном уровне обычно называют микроэлектроникой. За свои фундаментальные исследования в области полупроводников и открытие транзисторного эффекта в веществах типа германия и кремния Шокли, Бардин и Браттейн были удостоены Нобелевской премии в 1956.
См. также ЭЛЕКТРОВАКУУМНЫЕ И ГАЗОРАЗРЯДНЫЕ ПРИБОРЫ; ИНТЕГРАЛЬНАЯ СХЕМА; ТЕРМОЭЛЕКТРОННАЯ ЭМИССИЯ.
Широкий диапазон свойств твердых тел, широта области их технического применения, а также практически неисчерпаемые возможности создания новых твердых химических соединений выдвигают физику твердого тела на одно из первых мест в таких дисциплинах, как физика, химия, металлургия, различные области инженерной практики, а также биологические и медицинские науки. Физика твердого тела является самой крупной из областей физики; в ней занята примерно четверть всех работающих в физике исследователей, и ей посвящена соответствующая доля научных публикаций. Особенно ценны междисциплинарный характер физики твердого тела и плодотворное влияние, оказываемое ее теорией, экспериментами и практическими приложениями как на чистую науку, так и на технику.
Симметрия и классификация кристаллов.
Кристаллографией (в несколько ограниченном смысле слова) называется наука, описывающая геометрические свойства кристаллов и их классификацию на основе понятия симметрии. Изучение кристаллической структуры лежит в основе физики твердого тела. Основная сумма данных кристаллографии была накоплена уже к концу 19 в.
См. также КРИСТАЛЛЫ.
Образцы природных минералов, например берилла, алмаза или каменной соли, имеют плоские грани и прямые ребра, определяющие их типичный внешний вид (рис. 1). Такие вещества принято называть кристаллами, хотя еще до конца средних веков этот термин применялся исключительно к кварцу. Первые минералоги интересовались прежде всего именно формой кристаллов, т.е. их морфологией. Н.Стенон, датский лекарь при дворе великого герцога Тосканы и исследователь в области геологии, в 1669 открыл закон постоянства углов между гранями. Согласно закону Стенона, углы между соответствующими гранями кристалла данного вещества одни и те же для всех его кристаллов. Справедливость этого закона была многократно подтверждена, в особенности после многочисленных измерений, проведенных Р.де Лилем в 1772. Задолго до этого такие ученые, как Кеплер, Декарт, Гюйгенс и Гук, высказывали предположения о том, что внешние формы кристаллов отражают правильное (регулярное) внутреннее расположение сферических или эллипсоидальных частиц. В 1782 Р.Аюи обобщил эти представления. Он считал, что трехмерный кристалл, имеющий форму параллелепипеда, состоит из одинаковых «кирпичиков». Исходя из такого представления, Х.Вейсс в 1808 ввел систему кристаллографических осей, определяемую тремя векторами a, b, c, которые соответствуют трем сторонам «кирпичика» Аюи, т.е. элементарной ячейки. Бесконечное множество точек (узлов), положение которых определяется вектором R = n1a + n2b + n3c, где n1, n2 и n3 – целые числа, называется пространственной решеткой. Такая решетка – не кристалл, а чисто математический объект. Однако с ее помощью можно построить кристалл, если в каждый ее узел поместить повторяющийся элемент, состоящий из одного или нескольких атомов (рис. 2). И наоборот, можно построить пространственную решетку, соответствующую кристаллу, если выбрать произвольную точку (узел) P1, а затем найти все остальные точки P2, P3,..., обладающие тем свойством, что окружение этих точек выглядит во всех отношениях в точности так же, как оно выглядит из точки P1. Множество точек P1, P2, P3,... в таком случае образует пространственную решетку кристалла.
Классификация решеток и кристаллов на основе понятия симметрии требует строгих определений. Операцией симметрии называется такая операция, которая, будучи произведена над твердым телом, оставляет это тело неизменным, и тогда это тело называется инвариантным относительно этой операции. (Например, сфера инвариантна по отношению к вращению вокруг любой оси, перемещению из одного места в другое, отражению в зеркале и т.п.) Если двумерную решетку на рис. 2 подвергнуть перемещению, задаваемому вектором a, то мы вновь получим исходную решетку; то же справедливо, разумеется, и по отношению к перемещению, задаваемому вектором b. Вообще говоря, решетка с элементарной ячейкой, заданной тремя векторами a, b, c, инвариантна относительно всех операций трансляции (переноса), определяемых равенством T = n1a + n2b = n3c, где n1, n2, n3 – целые числа. Совокупность всех таких операций называется трансляционной группой данной решетки.
Существуют и другие операции симметрии для пространственной решетки, а именно те, при которых данная точка остается фиксированной (неподвижной). Подобные операции называются точечными и включают в себя вращения вокруг осей, проходящих через данную точку, а также зеркальные отражения в плоскостях, проходящих через данную точку. В случае двумерной решетки, изображенной на рис. 2, можно представить себе, например, ось, проходящую через какую-либо точку решетки перпендикулярно плоскости рисунка. Поворот вокруг этой оси на 180° не меняет решетку. Принято говорить, что такая ось обладает симметрией 2-го порядка. В общем случае тело обладает осью симметрии n-го порядка, если поворот тела на угол (360°/n) оставляет тело неизменным. Например, каждая пространственная диагональ куба является для него осью симметрии 3-го порядка, а ось, проведенная через центр куба перпендикулярно какой-либо паре его граней, является осью симметрии 4-го порядка. Полный набор операций симметрии, возможных при условии неподвижности данной точки и оставляющих тело неизменным, называется точечной группой этого тела. Для пространственной решетки или кристалла точечная симметрия ограничена требованием выполнения также трансляционной симметрии. Это сокращает число возможных осей вращения до четырех, обладающих соответственно симметрией 2-, 3-, 4- и 6-го порядков. Рисунок 3 поясняет, почему, например, решетка не может обладать осью симметрии 5-го порядка: плоскость нельзя покрыть пятиугольниками.
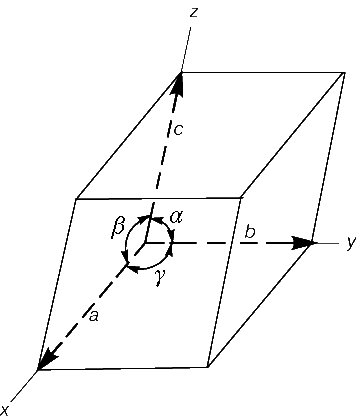
Существует лишь семь различных точечных групп для пространственных решеток; ими определяются семь кристаллических систем, или сингоний. Каждая сингония может быть охарактеризована видом элементарной ячейки, т.е. углами a, b, g между осями a, b, c и соотношением длин этих осей. Классификация соответствующих типов элементарных ячеек и наименования соответствующих кристаллических сингоний приведены ниже; обозначения ребер и углов ячеек соответствуют рис. 4.
| Кубическая | a = b = c, | a = b = g = 90° |
| Тетрагональная | a = b № c, | a = b = g = 90° |
| Орторомбическая | a № b № c, | a = b = g = 90° |
| Моноклинная | a № b № c, | a = g = 90° № b |
| Триклинная | a № b № c, | a № b № g № 90° |
| Гексагональная | a = b № c, | a = b = 90°, g = 120° |
| Тригональная | a = b = c, | a = b = g < 120°, № 90° |
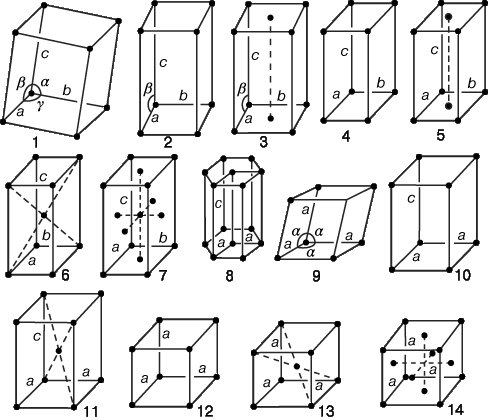
Полная группа симметрии, или пространственная группа кристалла, является совокупностью всех операций симметрии (точечных операций, трансляций, а также их всевозможных комбинаций), по отношению к которым решетка инвариантна. Существует 14 различных пространственных групп, которыми может обладать решетка; им соответствуют 14 различных пространственных решеток (рис. 5). Впервые эти решетки были описаны Браве в 1848 на основе тщательного геометрического анализа и носят его имя. (Каждая решетка Браве принадлежит к одной из семи кристаллических сингоний.)
Переходя от формального теоретического описания симметрии решетки к описанию реального кристалла, необходимо учитывать также симметрию атомов или атомных групп, помещаемых в каждый узел решетки. Тогда оказывается, что для кристаллов существует в общей сложности 230 различных пространственных групп (по-прежнему при 14 различных типах решеток Браве). Эти группы были получены и описаны на основе теории групп Е.С.Федоровым и С.Шенфлисом в 1891.
Интересное развитие теория симметрии кристаллов получила применительно к магнитным кристаллам. В магнитно-упорядоченном состоянии периодичность определяется не только положением атомов, но и направлением их магнитных моментов. Поэтому число магнитных пространственных групп должно быть намного больше 230. Полное число магнитных пространственных групп симметрии равно 1651. Для описания симметрии макроскопических свойств кристалла выделяют определенные совокупности преобразований симметрии, составляющие так называемый «магнитный кристаллический класс» кристалла. Всего существует 122 таких класса.
См. также МАГНИТЫ И МАГНИТНЫЕ СВОЙСТВА ВЕЩЕСТВА.
Хотя кристаллография сама по себе является довольно абстрактной областью науки, симметрия играет важную роль при описании физических свойств твердых тел. Например, трансляционная симметрия кристаллов позволила развить весьма общие теории, описывающие распространение волн в кристаллах, в том числе упругих волн и волн, связанных с движением электронов. Точечная симметрия также оказывает определяющее влияние на физические свойства кристаллов. В качестве примера можно указать на наличие сегнетоэлектрических свойств, в отсутствие внешнего электрического поля, лишь у кристаллов, не обладающих центром симметрии. Анизотропия физических свойств кристаллов, т.е. зависимость этих свойств от направления, также определяется условиями симметрии. Коротко можно сказать, что кристаллография отражает фундаментальный аспект физики твердого тела.
См. также АТОМА СТРОЕНИЕ; СТАТИСТИЧЕСКАЯ МЕХАНИКА; СЕГНЕТОЭЛЕКТРИЧЕСТВО.
Кристаллическая структура и дифракция.
Экспериментальное исследование расположения атомов в кристаллах стало возможно лишь после открытия Рентгеном в 1895 рентгеновского излучения. Чтобы проверить, является ли это излучение действительно одним из видов электромагнитного излучения, Лауэ в 1912 посоветовал Фридриху и Книппингу пропустить рентгеновский пучок через кристалл и посмотреть, возникнет ли дифракционная картина. Опыт дал положительный результат.
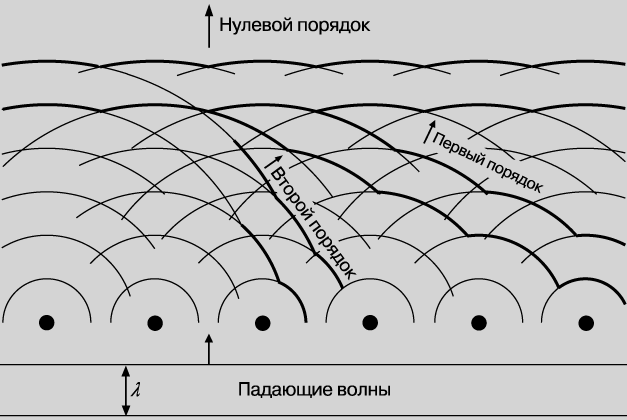
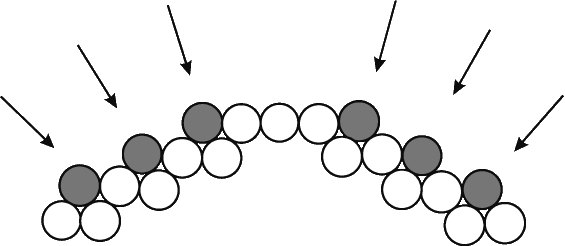
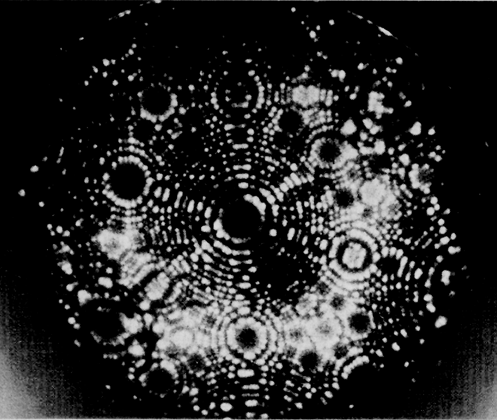
В основе опыта лежала аналогия с хорошо известным явлением дифракции в обычной оптике. Когда пучок света проходит через ряд малых отверстий, отстоящих друг от друга на расстояния, сравнимые с длиной световой волны, на экране наблюдается интерференционная (или, что в данном случае то же, дифракционная) картина из чередующихся светлых и темных областей. Точно так же, когда рентгеновские лучи, длина волны которых сравнима с расстояниями между атомами кристалла, рассеиваются на этих атомах, на фотопластинке возникает дифракционная картина. Суть явления дифракции поясняется на рис. 6, где изображены плоские волны, падающие на ряд рассеивающих центров. Под действием падающего пучка каждый такой центр испускает сферические волны; эти волны интерферируют друг с другом, что приводит к образованию волновых фронтов, распространяющихся не только в направлении первоначального падающего пучка, но и в некоторых других направлениях. Так называемая картина дифракции Лауэ (лауэграмма), полученная при прохождении пучка рентгеновского излучения сквозь тонкую кристаллическую пластинку минерала берилла, представлена на рис. 7. Картина дифракции ясно показывает наличие вращательной оси симметрии 6-го порядка, что характерно для гексагональной кристаллической структуры. Таким образом, эта картина несет важную информацию о структуре кристалла, на котором происходит дифракция, что и было, в частности, предметом изысканий У.Брэгга и его сына У.Брэгга.
См. также ОПТИКА; ЭЛЕКТРОМАГНИТНОЕ ИЗЛУЧЕНИЕ; РЕНТГЕНОВСКИЕ ЛУЧИ.
На основе явления дифракции рентгеновского излучения отец и сын Брэгги создали необычайно ценный экспериментальный метод рентгеноструктурного анализа кристаллов. Их работы знаменуют собой начало современной физики твердого тела. Соответствующее весьма сложное автоматизированное оборудование стало теперь обычным в лабораториях по физике твердого тела. Благодаря таким рентгеновским установкам и компьютерам определение расположения атомов даже в сложном кристалле стало почти рутинным делом. В 1914 Лауэ был удостоен за свои достижения Нобелевской премии; отец и сын Брэгги разделили такую же награду годом позднее.
Мощь рентгеноструктурного анализа основана на его высокой избирательности. Например, если монохроматический пучок рентгеновского излучения падает в произвольном направлении на монокристалл, можно наблюдать выходящий (но не дифрагированный) пучок в том же направлении. Дифрагированные пучки возникают лишь при нескольких строго определенных (дискретных) углах падения относительно кристаллографических осей. Это условие лежит в основе метода вращения кристалла, в котором допускается вращение монокристалла относительно определенной оси, причем точно определяются те направления, для которых наблюдается дифракция. В других экспериментах могут использоваться порошкообразные кристаллические образцы и монохроматический пучок; – такой метод носит название Дебая – Шеррера. В этом случае имеется непрерывный спектр ориентаций отдельных кристаллитов, но достаточно интенсивные дифрагированные пучки дают лишь кристаллиты с определенной ориентацией. Порошковый метод не требует выращивания крупных монокристаллов, в чем и состоит его преимущество перед методами Лауэ и вращения кристалла. В методе Лауэ используются монокристалл и пучок рентгеновского излучения, обладающий непрерывным спектром, так что кристалл как бы сам выбирает подходящие длины волн для образования дифракционных картин (рис. 7).
Какого же рода информацию о структуре кристалла может дать рентгеноструктурный анализ? Рентгеновское излучение – это электромагнитные волны, электрические поля которых взаимодействуют с заряженными частицами, а именно с электронами и атомами твердого тела. Поскольку масса электронов значительно меньше массы ядра, рентгеновское излучение эффективно рассеивается только электронами. Таким образом, рентгенограмма дает информацию о распределении электронов. Зная направления, в которых дифрагировало излучение, можно определить тип симметрии кристалла или кристаллический класс (кубический, тетрагональный и т.п.), а также длины сторон элементарной ячейки. По относительной интенсивности дифракционных максимумов можно определить положение атомов в элементарной ячейке. По существу дифракционная картина представляет собой математически преобразованную картину распределения электронов в кристалле – ее так называемый фурье-образ. Следовательно, она несет информацию и о структуре химических связей между атомами. Например, по рентгенограмме можно судить, действительно ли поваренная соль (NaCl) составлена из положительных и отрицательных ионов, а также о том, где находятся электроны в таком веществе, как германий. Наконец, распределение интенсивности в одном дифракционном максимуме дает информацию о размере кристаллитов, а также о несовершенствах (дефектах) решетки, механических напряжениях и других особенностях кристаллической структуры.
См. также ХИМИЯ.
Хотя рентгеноструктурный анализ является старейшим методом изучения твердых тел на атомном уровне, он продолжает развиваться и совершенствоваться. Одно из таких усовершенствований состоит в применении электронных ускорителей в качестве мощных источников рентгеновского излучения – синхротронного излучения. Синхротрон – это ускоритель, который обычно используется в ядерной физике для разгона электронов до очень высоких энергий (см. также УСКОРИТЕЛЬ ЧАСТИЦ). Электроны создают электромагнитное излучение в диапазоне от ультрафиолетового до рентгеновского излучения. В сочетании с недавно разработанными твердотельными детекторами частиц эти новые источники смогут, как ожидается, дать много новой детальной информации о твердых телах.
См. также ДЕТЕКТОРЫ ЧАСТИЦ.
В исследованиях в области физики твердого тела используется дифракция не только рентгеновского излучения, но и электронов и нейтронов. Возможность дифракции электронов и нейтронов основана на том, что частица, движущаяся со скоростью v, ведет себя как волна с длиной волны де Бройля l = h/mv, где h – постоянная Планка, m – масса частицы. Поскольку электроны заряжены, они интенсивно взаимодействуют с электронами и ядрами твердого тела. Поэтому, в отличие от рентгеновского излучения, они проникают лишь в тонкий поверхностный слой твердого тела. Но как раз это ограничение делает их весьма подходящими для изучения именно поверхностных свойств твердого тела.
См. также АТОМ.
Нейтроны были открыты в 1932. Четыре года спустя их волновая природа была подтверждена дифракционными экспериментами. Использование нейтронов в качестве средства исследования твердых тел стало возможным после создания ядерных реакторов, в которых, начиная примерно с 1950, создавались плотности потока нейтронов порядка 1012 нейтрон/см2Чс. Современные реакторы обеспечивают потоки, в тысячи раз более интенсивные.
См. также ЯДЕР ДЕЛЕНИЕ.
Нейтроны, будучи нейтральными частицами, взаимодействуют только с ядрами твердого тела (по крайней мере, в немагнитных материалах). Это свойство существенно по ряду причин. Поскольку ядра чрезвычайно малы по сравнению с размерами атома, а взаимодействие между ядрами и падающими нейтронами является короткодействующим, нейтронный пучок обладает большой проникающей способностью и может быть использован для исследования кристаллов толщиной до нескольких сантиметров. Кроме того, нейтроны интенсивно рассеиваются ядрами как тяжелых, так и легких элементов. В противоположность этому рентгеновское излучение рассеивается электронами, а потому для него рассеивающая способность атомов увеличивается с возрастанием числа электронов, т.е. атомного номера элемента. Следовательно, положение атомов легких элементов в кристалле можно гораздо точнее определять методом нейтронной, а не рентгеновской дифракции. Это в особенности относится к ядрам атомов водорода, или, что эквивалентно ионам водорода, – протонам. Протоны могут быть обнаружены методом дифракции нейтронов, но не рентгеновского излучения, поскольку они не содержат электронов. Это свойство нейтронов приобретает особое значение при изучении веществ, обладающих водородными связями. Подобные связи возникают не только в неорганических веществах, но и, в частности, в биологических материалах (например, молекулах ДНК).
См. также НУКЛЕИНОВЫЕ КИСЛОТЫ.
Нейтронные пучки играют важную роль при изучении твердых тел, поскольку нейтроны и ядра атомов имеют сравнимую массу. Поэтому при нейтронной бомбардировке твердого тела нейтроны могут возбуждать (и поглощать) решеточные волны, т.е. упругие волны, распространяющиеся в системе ядер кристалла. (Звуковая волна тоже является решеточной.) В таких неупругих столкновениях нейтрон теряет (или приобретает) энергию и импульс. Изменения этих величин могут быть измерены; они дают много детальной информации о динамических свойствах твердых тел. Таким образом, эксперименты по рассеянию нейтронов очень важны для исследования колебаний атомов в твердых телах. Наконец, дифракция нейтронов играет важную роль в изучении магнитных материалов. Хотя у нейтронов нет электрического заряда, они имеют дипольный магнитный момент, подобный стрелке компаса (см. также МАГНИТЫ И МАГНИТНЫЕ СВОЙСТВА ВЕЩЕСТВА). Поэтому нейтрон способен «видеть» магнитный атом в том смысле, что он взаимодействует с суммарным магнитным моментом всех электронов в атоме. Пучок нейтронов, направляемый на магнитный кристалл, рассеивается ядрами, а также «магнитными» электронами. Эти два вида рассеяния дают информацию о кристаллической и магнитной структуре. Подобные эксперименты позволили обнаружить существование в твердых телах магнитно-упорядоченных структур – от обычной параллельной ориентации магнитных моментов в ферромагнетике (например, в железе) до сложных геликоидальных структур в редкоземельных металлах и их соединениях.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
Химические связи и физические свойства.
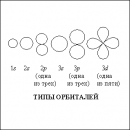
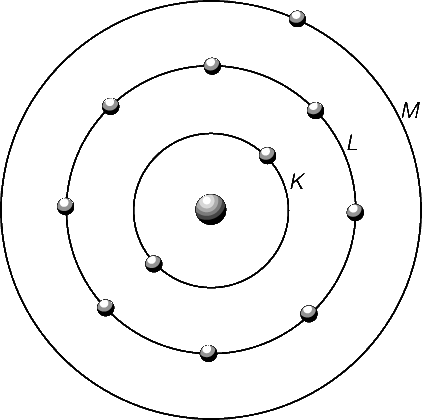
Свободный атом состоит из положительно заряженного ядра и некоторого числа отрицательно заряженных электронов, движущихся вокруг него по своим орбитам. В соответствии с законами квантовой механики электроны в атоме распределены по оболочкам, схематически изображенным на рис. 8 для атома натрия. Два ближайших к ядру электрона образуют K-оболочку, следующие восемь электронов – L-оболочку, а единственный внешний электрон – М-оболочку. Электронное облако простирается от ядра на расстояния, измеряемые ангстремами (1 Å = 10–10 м), оно же определяет эффективный размер атома, который, вообще говоря, не имеет резкой границы. Электроны внутренних оболочек сильно связаны и хорошо локализованы в кулоновском (электрическом) поле ядра. Электроны же внешней оболочки связаны слабее, поскольку действующее на них кулоновское поле ядра частично экранировано (ослаблено) внутренними электронами. Когда свободные атомы сближаются и образуют твердое тело (кристалл), внешние (валентные) электроны оказываются значительно более восприимчивыми к влиянию соседних атомов, чем внутренние (электроны остова). Волновые функции (орбитали) электронов остова в твердом теле почти такие же, как и у свободного атома. Орбитали же валентных электронов атомов твердого тела перестраиваются таким образом, чтобы его полная энергия была меньше суммы энергий отдельных атомов, чем и обеспечивается необходимая энергия связи твердого тела. Таким образом, твердое тело можно рассматривать как состоящее из большого числа жестких ионных остовов (ядер с электронами внутренних оболочек) и единой системы валентных электронов.
Таким образом, потеря индивидуальности атомами, составляющими твердое тело, сводится лишь к коллективизации валентных электронов. В зависимости от того, как распределены валентные электроны между ионными остовами и в промежутках между ними, различают четыре основных типа химической связи: ван-дер-ваальсова, ионная, металлическая и ковалентная. Характером связи в значительной степени определяются физические свойства твердого тела. Хотя для каждого из описываемых ниже типов связей имеются свои «типичные представители» среди реальных веществ, большинство твердых тел попадает в ту или иную промежуточную категорию.
Ван-дер-ваальсовские кристаллы.
Самые простые из известных твердых тел – кристаллы инертных газов неона, аргона, криптона и ксенона (см. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ). Электронная структура свободных атомов этих газов имеет конфигурацию так называемых замкнутых оболочек, отличающуюся исключительной устойчивостью. Например, неон имеет заполненную К-оболочку из двух электронов и заполненную L-оболочку из восьми электронов; эта конфигурация соответствует максимальному числу электронов в каждой оболочке, разрешенному правилами квантовой механики. На устойчивость конфигурации электронов в кристаллах инертных газов указывают высокие значения энергии ионизации, необходимой для удаления одного из внешних электронов. Такая устойчивость означает, что у атомов инертных газов нет валентных электронов в обычном смысле этого слова. Действительно, даже внешние электроны могут рассматриваться как электроны остова, сильно связанные с ядром. Поэтому электронная структура атомов в твердом теле остается практически такой же, как и у свободных атомов. Поскольку суммарный электрический заряд атомов равен нулю и все электроны сильно связаны с соответствующими ядрами, возникает вопрос, каким образом эти атомы вообще связываются в твердое тело? Дело в том, что между нейтральными атомами существуют слабые силы притяжения, обусловленные взаимодействием электрических диполей, которые индуцируются соседними атомами благодаря синхронизации движения своих электронов. Эти слабые и весьма чувствительные к различным факторам силы называются силами Ван-дер-Ваальса; ими и обусловлена связь между атомами и молекулами в большинстве органических кристаллов. Поскольку притяжение между атомами слабое, кристаллы инертных газов характеризуются малой энергией связи (т.е. энергией, необходимой для удаления атома из твердого тела), а также низкой температурой плавления. Ниже приведены численные значения этих величин для инертных газов в твердом состоянии.
| Неон | Аргон | Криптон | Ксенон | |
| Энергия ионизации, эВ | 21,6 | 15,8 | 14,0 | 12,1 |
| Энергия связи, эВ/атом | 0,02 | 0,08 | 0,12 | 0,17 |
| Температура плавления, К | 24 | 84 | 117 | 161 |
Ограниченный интервал температур, в котором существуют эти твердые тела, лишает их практического интереса. Однако они играют важную роль в фундаментальных исследованиях по теории образования кристаллов, динамике атомов в твердом теле, подвижности электронов, инжектированных в диэлектрики, и т.п. Поскольку атомы инертных газов имеют форму, близкую к сферической, силы Ван-дер-Ваальса между ними изотропны (т.е. одинаковы во всех направлениях). Поэтому неудивительно, что атомы инертных газов кристаллизуются в структуру, соответствующую самой плотной упаковке сфер, а именно в гранецентрированную кубическую структуру. Расстояние между соседними атомами возрастает с увеличением атомов, т.е. с увеличением числа электронов в них; для представленных выше элементов оно составляет 3,13, 3,76, 4,01 и 4,35Å.
Кристаллы инертных газов оказываются хорошими диэлектриками. Это можно объяснить тем, что все электроны в атомах сильно связаны со своими ядрами. Физические свойства таких твердых тел во многом определяются свойствами и электронной структурой атомов, из которых они построены.
Ионные кристаллы.
Идеальный ионный кристалл состоит из положительно и отрицательно заряженных сферических ионов. Этому представлению более всего соответствуют если не все, то по крайней мере некоторые щелочно-галоидные соединения, т.е. соли, образуемые одним из щелочных металлов (литий, натрий, калий, рубидий, цезий) и одним из галогенов (фтор, хлор, бром, иод). Имеются доказательства того, что кристаллы этих солей действительно образованы положительными ионами металлов и отрицательно заряженными ионами галогенов. Самое прямое из них – данные рентгеноструктурного анализа, на основе которых рассчитывается распределение электронного заряда (см. рис. 9 для случая NaCl).
То, что подобные твердые тела состоят из ионов, а не атомов, можно объяснить следующим образом. Прежде всего все атомы щелочных металлов имеют один внешний валентный электрон, тогда как внешняя оболочка атомов галогенов содержит семь валентных электронов. При переходе валентного электрона от атома щелочного металла к атому галогена образуются два иона, каждый из которых обладает устойчивой электронной конфигурацией, характерной для атомов инертных газов. Еще более важен выигрыш в энергии, обусловленный кулоновским притяжением между положительными и отрицательными ионами. Рассмотрим в качестве примера хлорид натрия (NaCl). Чтобы оторвать внешний (валентный) электрон от атома Na, нужно затратить 5,14 эВ (энергию ионизации). Когда этот электрон присоединяется к атому Cl, получается выигрыш в энергии, равный 3,61 эВ (энергия сродства к электрону). Таким образом, энергия, необходимая для перехода валентного электрона от Na к Cl, равна (5,14 - 3,61) эВ = 1,53 эВ. Кулоновская же энергия притяжения между двумя возникшими ионами Na+ и Cl- при расстоянии между ними (в кристалле), равном 2,18 Å, составляет 5,1 эВ. Эта величина с избытком компенсирует полную энергию перехода электрона и приводит к понижению полной энергии системы ионов по сравнению с аналогичной системой свободных атомов. В этом основная причина того, что щелочно-галоидные соединения состоят именно из ионов, а не атомов.
Вычисления энергии ионных кристаллов на самом деле сложнее, чем это может показаться из проведенных выше рассуждений. Но по крайней мере для щелочно-галоидных кристаллов наблюдается хорошее согласие между теоретическим и экспериментальным значениями энергии связи. Ионные связи достаточно сильны, на что указывает, например, высокая температура плавления, равная 1074 K для NaCl.
Благодаря высокой степени устойчивости электронной структуры ионные кристаллы попадают в разряд диэлектриков. Поскольку положительные и отрицательные ионы взаимодействуют с электромагнитными волнами, ионные кристаллы обнаруживают сильное оптическое поглощение в инфракрасной области спектра. (Частота осциллирующего внешнего электрического поля в этой области спектра близка к собственной частоте поперечных решеточных волн, в которых положительные и отрицательные ионы кристалла движутся во встречных направлениях.) В видимой области спектра частоты колебаний слишком велики, для того чтобы массивные ионы успевали реагировать на воздействие таких волн. Поэтому световые волны проходят через кристалл без взаимодействия, т.е. такие кристаллы прозрачны. При еще более высоких частотах – в ультрафиолетовой области спектра – кванты поля могут иметь достаточную энергию для возбуждения валентных электронов, обеспечивающего переход валентных электронов отрицательных ионов в незанятые состояния положительных ионов. Это приводит к сильному оптическому поглощению.
Ковалентные кристаллы.
Наиболее известные ковалентные кристаллы – это алмаз, кремний и германий. Каждый атом в таких кристаллах окружен четырьмя соседними атомами, расположенными в вершинах правильного тетраэдра. Свободные атомы каждого из указанных элементов имеют по четыре валентных электрона, а этого достаточно для образования четырех парных электронных связей (между данным атомом и четырьмя его ближайшими соседями). Таким образом, два электрона коллективизируются двумя атомами, образующими связь, и располагаются в пространстве вдоль линии, соединяющей атомы. Это почти такая же связь, как и между двумя атомами водорода в молекуле водорода H2. В алмазе эти связи очень сильны, и, поскольку они имеют строго определенное направление относительно друг друга, алмаз является чрезвычайно твердым материалом. Силу ковалентной связи электрона с кристаллом характеризует так называемая энергетическая щель – минимальная энергия, которую необходимо передать электрону, чтобы он мог свободно двигаться в кристалле и создавать электрический ток. Для алмаза, кремния и германия ширина этой щели составляет 5,4, 1,17 и 0,744 эВ соответственно. Поэтому алмаз является хорошим диэлектриком; энергия тепловых колебаний в нем при комнатной температуре слишком мала, чтобы освободить валентные электроны. В кремнии же и особенно в германии благодаря сравнительно малой ширине энергетической щели возможно тепловое возбуждение некоторого числа валентных электронов при комнатной температуре. Таким образом, они проводят ток, но поскольку их проводимость значительно меньше, чем у металлов, кремний и германий относятся к полупроводникам.
См. также ТРАНЗИСТОР.
Металлы.
Как упоминалось выше, валентные электроны в ковалентных твердых телах коллективизированы соседними атомами и локализованы вдоль линий, соединяющих эти атомы. В металлах коллективизация электронов достигает максимума – все валентные электроны коллективизируются всеми ионными остовами. Идеальный металл можно рассматривать как состоящий из периодически расположенных ионных остовов, которые погружены в газ электронов проводимости, свободно движущихся между ионными остовами. Стабильность металла и величина его энергии связи определяются кулоновскими силами притяжения между положительными ионными остовами и отрицательно заряженным электронным газом. Подвижные электроны проводимости ответственны за высокую электро- и теплопроводность металлов.
Такая модель металла со свободными электронами лучше всего подходит для щелочных металлов и менее пригодна для благородных металлов – меди, серебра и золота. В щелочных металлах ионные остовы занимают лишь малую долю полного объема (около 15%), тогда как в серебре и золоте соседние ионные остовы чуть ли не соприкасаются друг с другом.
Различие между четырьмя типами твердых тел поясняется схемами, представленными на рис. 10. Атомы и ионные остовы с сильно связанными электронами в конфигурациях с замкнутыми оболочками показаны светлыми кружками. Пространственное распределение валентных электронов показано только для ковалентных кристаллов и металлов.
Большинство твердых веществ занимает промежуточное положение между четырьмя «чистыми» типами связи. Например, существует непрерывный ряд твердых тел между чисто ионными и чисто ковалентными кристаллами. Поэтому в применении к таким непроводящим электрический ток материалам говорят о частично ионном или частично ковалентном характере связей. Дж. Филлипс предложил особенно успешный полуэмпирический подход к описанию существующих закономерностей в различных группах соединений на основе их диэлектрических свойств и ширины энергетических щелей.
См. также ЭЛЕКТРИЧЕСТВО И МАГНЕТИЗМ.
Интересно сравнить степени ионности связи в схеме Филлипса для соединений, составленных из элементов разных (или одной и той же) групп периодической системы: I и VII, II и VI, III и V, IV-IV, а также для элементов IV группы (см. также ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ). Для некоторых соединений эта характеристика имеет следующие значения:
| NaCl | MgS | GaAs | SiC | Si |
| 0,94 | 0,79 | 0,31 | 0,18 | 0 |
Здесь виден постепенный переход от почти полностью ионного соединения NaCl к чисто ковалентному кристаллу кремния.
Кристаллы с водородными связями.
Рассмотренная выше классификация кристаллов основана на связях, создаваемых электронами. Другой тип химической связи возникает благодаря ионам водорода (протонам). Протон – это особый вид иона: у него вообще отсутствуют электроны, а потому он имеет чрезвычайно малые размеры. «Голый» протон способен связывать друг с другом два отрицательных иона, в частности отрицательные ионы фтора, кислорода и азота. Например, ион дифторида водорода HF2-, обладающий линейной структурой F-H+F-, обязан своей устойчивостью наличию протона, связывающего два отрицательных иона фтора. Водородные связи играют важную роль в молекулярной биологии (прежде всего в генетике), поскольку они участвуют в удержании двух цепей двойной спиральной структуры молекул ДНК. Эти связи существенны также в физике сегнетоэлектриков (например, дигидрофосфата калия KH2PO4) и в значительной мере ответственны за удивительные физические свойства воды и льда.
ВЫРАЩИВАНИЕ КРИСТАЛЛОВ
Для изучения свойств тех или иных кристаллов необходимо приготавливать (выращивать) хорошие образцы – часто в форме монокристаллов самой высокой, насколько возможно, степени совершенства и химической чистоты. Для изучения же влияния различных физических или химических несовершенств на свойства твердых тел такие несовершенства (дефекты) требуется тем или иным способом контролируемо вводить в твердое тело. При этом в качестве исходных необходимо использовать материалы высокой химической чистоты. Помимо обычных химических методов очищения, многие металлы и полупроводники могут быть очищены методом зонной плавки.
См. также ЗОННАЯ ПЛАВКА.
Кристаллы можно выращивать, медленно выпаривая растворитель из раствора, охлаждая расплав или конденсируя пары. Кристаллы выращиваются из расплава по методу Бриджмена или Чохральского. При использовании метода Чохральского небольшой кристалл-затравка, укрепленный на вертикальной проволоке или стержне, погружается в расплав и затем медленно выводится из него. При соответствующем контроле за температурой и скоростью вытягивания из затравочного кристалла может вырасти крупный монокристалл. По методу Бриджмена расплав находится в вертикально закрепленном тигле с остроконечным дном. При медленном опускании тигля из горячей зоны печи в более холодную на его остром дне образуется кристалл-зародыш, который в ходе дальнейшего опускания тигля может вырасти в крупный монокристалл.
Метод молекулярной эпитаксии (ММЭ) позволяет последовательно слой за слоем наращивать полупроводниковые чипы на подходящей кристаллической подложке. В каждом слое (толщина которого может не превышать диаметра одного атома) точно повторяется кристаллическая структура подложки.
Нагревая ионный кристалл в парах его металлического компонента или какого-либо другого металла, в него можно ввести избыток этого металла. Во многих случаях такие легированные кристаллы обнаруживают новые интересные свойства, обусловленные именно этими внедренными на атомном уровне металлическими компонентами. Например, при нагревании хлорида натрия в парах натрия кристалл из прозрачного становится желто-коричневым; в этом случае говорят, что в кристалле появились центры окраски. В ряде случаев атомы металла, введенные в кристалл при его нагревании в металлических парах, могут коагулировать в небольшие металлические кристаллы, внедренные в исходный ионный кристалл.
Электронная микроскопия высокого разрешения.
В обычном оптическом или световом микроскопе предел разрешения определяется относительно большим значением длины волны видимого света. Это означает, что не могут наблюдаться детали протяженностью менее примерно 5000 Å. В электронном микроскопе вместо света используется пучок электронов с длиной волны около 0,04 Å, что значительно меньше даже диаметра атома. Первый практически применимый электронный микроскоп был создан Э.Руской (Берлин, 1933). С тех пор ученые стремились получить изображение отдельного атома, и в конечном итоге электронная микроскопия стала надежным, хорошо апробированным методом исследования. С ее помощью удалось получить многие сведения из области биологии (строение бактерий, вирусов), а также данные о структуре кристаллов. Техническое усовершенствование электронной микроскопии позволило достичь разрешения порядка нескольких ангстрем. Это дает возможность получать непосредственно интерпретируемые изображения распределения атомов металла внутри элементарной ячейки твердого тела. Некоторые интересные исследования проводились, например, в университете шт. Аризона. Когда один из оксидов ниобия (химическая формула Nb22O54) нагревается в атмосфере газообразного водорода, образуется вещество с химическим составом Nb12O29, которое встраивается в исходный материал. Это можно увидеть в электронном микроскопе высокого разрешения. Исходный оксид Nb22O54 характеризуется правильным чередованием рядов из блоков 3ґ3 и 3ґ4, состоящих из октаэдров, в центре которых расположен атом ниобия, а в вершинах – шесть атомов кислорода. На рис. 11 показано, каким образом нарушается исходный порядок чередования в местах, отмеченных на рисунке стрелками, где один за другим идут два одинаковых ряда (из блоков 3ґ4). Такие двумерные дефектные слои (называемые дефектами Уодсли) проходят по всему кристаллу перпендикулярно плоскости рисунка. Данный пример показывает, что электронная микроскопия – мощный метод исследования в физике твердого тела.
См. также ЭЛЕКТРОННЫЙ МИКРОСКОП.
Прямое изображение поверхностных атомов.
Для исследователей, интересующихся объемными свойствами твердых тел, поверхность образца представляет собой главным образом помеху. Однако поверхность кристалла играет важную роль во многих физических и химических явлениях, существенных, например для работы различных полупроводниковых и микроэлектронных устройств, а также в химической коррозии и гетерогенном катализе.
При исследовании свойств поверхности твердого тела первостепенное значение имеет надежная информация о расположении атомов в наружном атомном слое кристалла. Существенный прогресс в этой области был достигнут благодаря применению техники сверхвысокого вакуума, дифракции электронов низких энергий и экспериментов по рассеянию атомов или ионов. В исследованиях поверхности твердого тела успешно применяется автоионный проектор, созданный в 1955 Э.Мюллером в университете шт. Пенсильвания. Этот прибор позволил, например, получить прямое изображение отдельных атомных позиций.
Металлические стекла.
Интересным развитием физики твердого тела явилось открытие нового типа материалов, названных металлическими стеклами. В расположении атомов стеклообразных веществ обнаруживается (как и в жидкостях) некоторый ближний порядок, но характерный для кристалла дальний порядок в нем отсутствует. Металлы обычно быстро кристаллизуются при охлаждении из жидкого состояния. В настоящее время можно проводить очень быстрое охлаждение (со скоростью до 105-106 кельвинов в 1 с), которое дает стеклообразный металл с беспорядочным расположением атомов. Такие металлические стекла интересны своими необычными, а иногда и уникальными физическими свойствами. В частности, они очень тверды, прочны и пластичны, т.е. в отличие от силикатных стекол не хрупки. Они хорошо проводят электричество; их проводимость сравнима с проводимостью обычно используемых в электротехнике сплавов; поэтому металлические стекла – хороший материал для резисторов, термометров сопротивления, низкотемпературных нагревательных элементов и т.п. Много внимания уделялось магнитным свойствам металлических стекол. Оказалось, что ферромагнитные стекла могут намагничиваться и размагничиваться очень слабыми внешними магнитными полями. Благодаря этому и механической прочности магнитные стекла пригодны для использования в трансформаторах, магнитных усилителях, а также звукозаписывающих головках.
Этот метод исследования основан на фотоэлектрическом эффекте – вещество поглощает рентгеновское излучение и испускает электроны (см. также ФОТОЭЛЕКТРИЧЕСКИЙ ЭФФЕКТ). Рентгеновское излучение представляет собой электромагнитные волны высокой частоты. Согласно квантовой теории, они могут поглощаться в веществе только строго определенными порциями – так называемыми квантами, или фотонами. В фотоэлектрическом процессе энергия фотона полностью передается электрону. Часть этой энергии (так называемая работа выхода) затрачивается на вырывание электрона из твердого тела, а остальная часть переходит в кинетическую энергию испущенного электрона. При методе РФЭС регистрируется распределение кинетической энергии испускаемых электронов. По нему рассчитывается спектр энергий связи электронов в твердом теле – одна из важных характеристик материала.
За время, прошедшее после пионерских работ К.Зигбана и его сотрудников, начатых около 1955 (и удостоенных Нобелевской премии по физике за 1992), благодаря созданию надежной техники сверхвысокого вакуума, необходимой для предотвращения окисления и загрязнения поверхности, РФЭС стала одним из важных методов исследований в физике твердого тела и микроэлектронике.
См. также СПЕКТРОСКОПИЯ; ВАКУУМНАЯ ТЕХНИКА.
Холден А. Что такое ФТТ. Основы современной физики твердого тела. М., 1971
Шаскольская М.П. Кристаллы. М., 1978
Гегузин Я.Е. Живой кристалл. М., 1981
Чернов А.А. Физика кристаллизации. М., 1983
Каганов М.И., Лифшиц Е.М. Квазичастицы. Идеи и принципы квантовой физики твердого тела. М., 1989
Ответь на вопросы викторины «Физика»